Catalase
| Catalase | ||
|---|---|---|
| ||
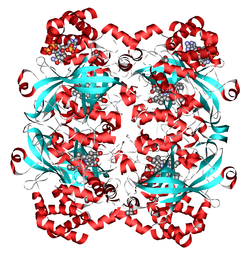
| Model de panglică de catalază umană conform PDB 1DGF | ||
| Proprietățile proteinelor umane | ||
| Structura primară de masă / lungime | 526 aminoacizi | |
| Secundar față de structura cuaternară | Homotetramer | |
| Cofactor | Hamm | |
| Identificator | ||
| Numele genei | PISICĂ | |
| ID-uri externe | ||
| Clasificarea enzimelor | ||
| CE, categorie | 1.11.1.6 , oxidoreductaza | |
| Substrat | 2 H 2 O 2 | |
| Produse | O 2 + 2 H 2 O | |
| Apariție | ||
| Familia de omologie | Catalase | |
| Taxon părinte | Creatură | |
Catalaza ( denumirea genei : CAT ) este o enzimă care transformă peroxidul de hidrogen (H 2 O 2 ) în oxigen (O 2 ) și apă (H 2 O). Peroxidul de hidrogen este produs atunci când hiperoxizii sunt defalcați de superoxid dismutază . Este un produs secundar prin al defalcării a purinelor și oxidarea de acizi grași și pot deteriora genomul si proteinele . Calazelor sunt , prin urmare , găsite în aproape toate aerob organismele vii, la om , în principal , în peroxisomes de ficatului și rinichilor , precum și în eritrocite . Mutațiile în CAT gena poate duce la ereditar catalazei deficit ( akatalasia ), care este comună în Japonia .
Sistematică
Pe baza secvenței și structurii , catalazele sunt împărțite în trei clase.
- enzime monofuncționale care conțin hem
- peroxidaze catalazice bifuncționale care conțin hem
- enzime care conțin mangan (fără grupa hem)
Catalaza umană ( PDB 1DGF ) constă din patru subunități identice de câte 60 kDa fiecare . Fiecare dintre acestea conține un grup hem și un site de legare NADPH .
Reacție catalizată
Reacția are loc în doi pași. În primul pas, peroxidul de hidrogen este redus și enzima este oxidată , creând apa produsă.
În a doua etapă, atât peroxidul de hidrogen cât și enzima sunt reduse, iar oxigenul este oxidat și astfel eliberat ca produs împreună cu o altă moleculă de apă.
Ecuația sumă este:
Atât numărul cifrei de afaceri , cât și eficiența catalitică a enzimei sunt printre cele mai mari valori găsite vreodată pentru enzime ( tabel ).
La concentrații scăzute de peroxid de hidrogen, catalaza oxidată poate oxida metanolul și etanolul prin aldehidă pentru a forma un acid .
Utilizare în laborator
În microbiologie, testul catalazei este utilizat pentru a face diferența între bacterii. Diferențierea stafilococilor catalazici pozitivi de streptococii catalazici negativi este de o importanță clinică deosebită. O picătură de reactiv catalazic (3% soluție de peroxid de hidrogen) este plasată pe o lamă și o buclă de material bacterian este ținută pe scurt. Reacție pozitivă: bule directe, formare de bule; Reacție negativă: nici o efervescență întârziată. Alternativ, peroxidul de hidrogen diluat poate fi picurat direct pe o colonie bacteriană pe o placă de agar.
Majoritatea bacteriilor anaerobe aerobe și facultative, precum și a ciupercilor, au enzima catalază, care este capabilă să descompună H 2 O 2 , care este toxică pentru celule .
Peroxidul de hidrogen este utilizat experimental în biologie pentru a induce moartea celulară programată în celulele eucariote izolate.
utilizare
Pentru neutralizarea peroxidului de hidrogen în produsele de curățat cu lentile de contact cu 2 componente.
Dovezi individuale
- ↑ catalază. În: Moștenirea mendeliană online în om . (Engleză).
- ↑ P. Chelikani și colab.: Articolul. În: CMLS, Cellular and Molecular Life Sciences , 61, 2004, pp. 192-208; doi: 10.1007 / s00018-003-3206-5 (engleză)
- ↑ CD Putnam și colab.: Articol. În: Journal of Molecular Biology , 296, 2000, pp. 295-309; doi: 10.1006 / jmbi.1999.3458 (engleză)
- ↑ Informații despre tip sau dovezi individuale lipsesc.
- ↑ Oliver Auferkamp: Investigarea mecanismului de reacție al catalazei ficatului de vită . Duisburg / Essen 2007, p. 18 , urn : nbn: de: hbz: 465-20080305-090734-6 (disertație, Universitatea din Duisburg-Essen).
Link-uri web
- Jennifer McDowall / Interpro: Proteina lunii: Catalază. (Engleză)



