Ortho și para hidrogen
Ortho și parahidrogenul (o - H 2 și p - H 2 pe scurt ) sunt două forme ale moleculei de dihidrogen care diferă prin simetria configurației lor de spin nuclear și a stărilor de rotație. Deși au aceeași structură chimică , unele dintre ele au proprietăți fizice diferite. Hidrogenul este în general un amestec al ambelor specii; raportul de amestecare în echilibru termodinamic depinde de temperatură .
Existența celor două forme trebuie de ex. B. să fie luat în considerare la lichefierea hidrogenului, mai ales dacă acesta urmează să fie folosit ca combustibil pentru rachete . În plus, ordinea de simetrie a hidrogenului para poate fi utilizată pentru amplificarea semnalului rezonanței magnetice nucleare ( hiperpolarizare ), pentru spectroscopia de rezonanță magnetică nucleară (RMN) și imagistica prin rezonanță magnetică (MRT).
Bazele fizice
Nucleul unui atom de hidrogen este un proton simplu (dacă se neglijează izotopii mai grei deuteriu și tritiu , care împreună reprezintă mai puțin de 0,02%). Protonul are o rotire cu o valoare care poate presupune două stări diferite: „sus” și „jos” .
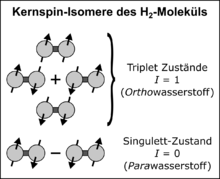
Spinul nuclear are în mod normal doar o influență foarte mică asupra atomului și moleculei respective (în ordinea unui maxim de câțiva μeV , vezi structura hiperfină ). În cazul H2 , există , de asemenea, un efect mecanic cuantic special: cei doi protoni sunt particule care nu se disting , deci trebuie priviți ca un întreg. Conform regulilor mecanice cuantice pentru impuls unghiular, cele două rotiri nucleare se cuplează pentru a forma o rotire totală care poate lua valorile 0 și 1. Există patru eigenstates ale funcției de undă de spin nuclear: trei triplet cu și numere cuantice magnetice de spin și o stare de singlet cu și . Cele trei stări triplet sunt simetrice si sunt numite Ortho stări ( Ortho hidrogen, sau o - H 2 pentru scurt ); starea singlet este antisimetrică și este numită para stat ( para hidrogen, p - H 2 pentru scurt ). În notația Dirac , cele patru stări proprii sunt scrise după cum urmează:
Deoarece hidrogen nuclee de spin - 1 / 2 particule sunt, ele urmează statisticile Fermi-Dirac . Aceasta înseamnă că starea mecanică cuantică a întregii molecule de hidrogen trebuie să fie antisimetrică în ceea ce privește schimbul celor doi protoni ( principiul Pauli ). Pentru aceasta, funcția de undă totală a celor două nuclee trebuie să fie antisimetrică. Acest lucru poate fi reprezentat ca produs al poziției și al funcției de undă de rotire a celor doi protoni ai moleculei H 2 și este exact atunci antisimetric dacă unul dintre cei doi factori ai produsului este antisimetric, iar celălalt este simetric. După cum reiese din funcțiile de undă date mai sus, componenta de spin este simetrică pentru orto-hidrogen și antisimetrică pentru para-hidrogen. Numărul cuantic de rotație J , care corespunde unui moment unghiular orbital, este decisiv pentru simetria funcției undei spațiale . Într-un J drept funcția undei spațiale pentru simetric impar, J antisimetric. Pentru p - H 2 , J este par, cea mai mică valoare posibilă este J = 0. Pentru o - H 2 , J este impar, cea mai mică valoare posibilă este J = 1. Energia de rotație a moleculei H 2 este proporțională cu J · (J + 1) , deci starea de energie cea mai mică a lui o - H 2 este mai mare decât cea a lui p - H 2 . Diferența este de 1,455 kJ / mol (≙ 15,1 m eV , ≙ 175 K ).
În general, hidrogenul este un amestec de o - H 2 și p - H 2 (sau toate cele patru stări proprii ale spinului nuclear); distribuția de echilibru dependentă de temperatură satisface statisticile Boltzmann . Raportul de echilibru dependent de temperatură al lui o - H 2 / p - H 2 este descris de
- ,
unde Θ r = h · c · B / k temperatura de rotație este conectat la constantele de rotație B . Factorii 3 și 1 din numărător și numitor corespund multiplicității stărilor de spin nuclear (3 pentru orto și 1 pentru parahidrogen); factorii sunt multiplicitatea stărilor J individuale .
La temperaturi ridicate, multe state J sunt ocupate, valoarea limită este atunci și corespunde unei distribuții uniforme a celor patru stări de centrifugare nucleară (75% o - H 2 și 25% p - H 2 ). Acest raport este aproape atins la temperatura camerei. La temperaturi scăzute, pe de altă parte, sunt ocupate doar niveluri de energie cu un J foarte mic , diferența de energie dintre o - H 2 cu J = 1 și p - H 2 cu J = 0 are un efect crescător. În cazul limită se aplică T → 0 K , deoarece atunci este ocupat doar cel mai mic nivel de rotație J = 0; proporția de p - H 2 este de 100%.
Proprietăți fizice
Tranziția o - H 2 → p - H 2 + hν este suprimată puternic ca „ tranziție interzisă “; izolat o - H 2 are o durată de viață de cel puțin câteva secole. Chiar și la presiune normală și o temperatură nu prea ridicată în faza gazoasă , tranziția prin reacția H + o - H 2 → H + p - H 2 are un timp de înjumătățire de câțiva ani. Transformarea, adică abordarea distribuției de echilibru, are loc în mod corespunzător lent. Cu toate acestea, acest proces poate fi accelerat cu cataliză omogenă și heterogenă , de exemplu cu cărbune activ sau materiale feromagnetice .
Ortho și para hidrogenul diferă în unele proprietăți fizice de bază . Au capacități termice semnificativ diferite, dar și conductivități electrice diferite și dependențe de temperatură diferite ale acestor două mărimi. În plus, o - H 2 poate fi măsurat folosind metoda rezonanței magnetice nucleare (RMN), în timp ce p - H 2 cu rotire totală I = 0 este „invizibil RMN”. În afară de aceasta, proprietățile fizice sunt doar ușor diferite. De exemplu, punctele de topire și fierbere ale formei para sunt cu aproximativ 0,1 K mai mici decât cele ale formei orto.
istorie
Comportamentul căldurii specifice a hidrogenului, în special la temperaturi scăzute, a rămas inexplicabil pentru o lungă perioadă de timp. În 1912 Arnold Eucken a observat scăderea componentei de rotație a căldurii specifice în hidrogen gazos între 300 și 60 Kelvin, ceea ce în acel moment nu putea fi explicat teoretic. La fel, Reinhard Meckenheim 1922 a avut o modificare a intensității raportului 1: 3 descoperită în spectrele de bandă ale moleculelor diatomice cu atomi identici. Abia după dezvoltarea mecanicii cuantice , care Werner Heisenberg a putut demonstra în 1926 că cei doi de spin izomeri ai celor H 2 molecule sunt responsabile pentru aceasta, procedând în mod analog cu electronii din orto- și para-heliu . Dovada experimentală a celor doi izomeri a fost realizată în 1929 de Karl Friedrich Bonhoeffer și Paul Harteck la Institutul Kaiser Wilhelm pentru Chimie Fizică și Electrochimie din Berlin-Dahlem. Mai târziu, Heisenberg a primit Premiul Nobel pentru fizică „pentru crearea mecanicii cuantice, a cărei aplicare, printre altele, a dus la descoperirea diferitelor forme de hidrogen” .
Aplicații
Producerea și depozitarea hidrogenului lichid
Deoarece starea de bază a parahidrogenului este mai mică în energie decât cea a ortohidrogenului, diferența de energie este eliberată sub formă de căldură în timpul conversiei orto-para . După cum sa menționat mai sus, însă, conversia este lentă, ceea ce înseamnă că are loc cu o întârziere în timpul răcirii și lichefierii (± 21 K) în condiții normale. Energia eliberată (entalpia de conversie) este 1,091 J / mol ( cu 3 / 4 din entalpia de conversie pentru 100% p - H 2 ) mai mare decât căldura de evaporare (904 J / mol), care este necesar pentru a transforma hidrogenul lichid într - un condamnat de stat gazos. Prin urmare, datorită conversiei orto-para, chiar și cu izolație termică completă, o parte semnificativă a hidrogenului lichid se evaporă dacă nu se iau măsurile de precauție adecvate în timpul lichefierii. În producția industrială de hidrogen lichid, conversia în timpul răcirii este, prin urmare, accelerată catalitic , încă în fază gazoasă .
Propulsie cu rachete
Hidrogenul lichid este utilizat drept combustibil pentru rachete în tehnologiile de rachete bazate pe hidrogen-oxigen, ceea ce înseamnă că cantități mai mari de H 2 pot fi transportate. Și aici, evaporarea accelerată prin conversia o - H 2 -p - H 2 ar fi nedorită, motiv pentru care hidrogenul lichid este alimentat în echilibru termic .
Parahidrogen în RMN și RMN
Parahidrogenul îmbogățit este utilizat în chimie și medicină pentru a amplifica semnalul de rezonanță magnetică nucleară (variabilă măsurată a RMN și MRT ) cu mai multe ordine de mărime ( hiperpolarizare ). Starea pură este utilizată pentru a transfera ordinea de rotire către o moleculă țintă. Efectul a fost descoperit de Bowers și Weitekamp și numit „PASADENA” (Parahidrogenul și sinteza permit alinierea nucleară îmbunătățită dramatic). Astăzi, metoda este adesea denumită „PHIP” (ParaHidrogen Induced Polarization). Metoda a fost utilizată pentru a studia evoluția reacțiilor de hidrogenare. Cercetările actuale vizează dezvoltarea de noi tipuri de medii de contrast RMN .
Apa orto și para
Ca și cu H 2 molecula, se poate , de asemenea , diferențierea între orto și para un stat pentru molecula de apă (H 2 O), în funcție de faptul dacă spinii nucleele de hidrogen sunt paralele sau antiparalel. (Cu excepția izotopului foarte rar 17 O, nucleul de oxigen nu are rotire.) Și aici, stările de rotație ale moleculei sunt legate de rotirea nucleară: starea de bază a para-apei are numărul cuantic de rotație j = 0, cel al orto-apei, numărul cuantic de rotație j = 1. Para- și orto-apa pot fi separate prin expunerea unui fascicul molecular H 2 O la un câmp electric puternic. S-ar putea dovedi că cele două forme de apă au proprietăți chimice diferite: Reacția cu ionul diazeniliu
rulează cu 23 ± 9% mai repede cu para-apă decât cu orto-apă.
Vezi si
Atom de heliu # Ortho și paraheliu cu stări similare ale electronului se învârte în atomul de heliu
Dovezi individuale
- ↑ Stările de vibrație nu joacă un rol aici, deoarece sunt excitate doar la o temperatură semnificativ mai mare. Chiar și prima stare de vibrație are o energie de 516 meV (corespunzând la 5980 K).
- ↑ a b c d Descoperirea para-hidrogenului. În: mpibpc.mpg.de. Institutul de chimie biofizică Max Planck .
- ^ Robert R. Reeves, Paul Harteck: Ortho and Parahydrogen in Interstellar Material . În: Z. Naturforsch. Nr. 34a, 1979, pp. 163-166.
- ^ Clifford R. Bowers: Îmbunătățirea sensibilității folosind parahidrogen . În: eMagRes . John Wiley & Sons, Ltd., New York 2007, ISBN 978-0-470-03459-0 , doi : 10.1002 / 9780470034590.emrstm0489 .
- ^ A b Johannes Natterer, Joachim Bargon: polarizarea indusă de parahidrogen . În: Progresul în spectroscopia de rezonanță magnetică nucleară . bandă 31 , nr. 4 , noiembrie 1997, ISSN 0079-6565 , p. 293-315 , doi : 10.1016 / S0079-6565 (97) 00007-1 .
- ↑ Adalbert Farkas: Hidrogen orto și parahidrogen cu hidrogen greu . University Press, Cambridge 1935, DNB 362436835 .
- ^ J. Hord și colab.: Proprietăți selectate ale hidrogenului (date de proiectare inginerie). ( Memento din 20 februarie 2017 în Arhiva Internet ). (PDF; 16,3 MB).
- ↑ Oameni de știință importanți. Werner Heisenberg (1901–1976). În: physicsoftheuniverse.com. Adus la 16 august 2016 .
- ^ Manne Siegbahn : Premiul de fizică. În: Fundația Nobel: Nobel: Omul și premiile sale. (New York: Elsevier Publishing Co., 1962), pp. 492-497.
- ↑ a b N. Getoff: hidrogenul ca combustibil: producția, depozitarea, transportul. Springer-Verlag, 2013, ISBN 978-3-7091-7694-8 .
- ↑ AH Larsen, FE Simon, CA Swenson: Rata de evaporare a hidrogenului lichid datorită conversiei orto-para a hidrogenului. În: Rev. Sci. Instrum. 19: 266 (1948); doi: 10.1063 / 1.1741241.
- ↑ J.-B. Hövener și colab.: Un convertor de parahidrogen cu flux continuu, de mare viteză și de înaltă presiune pentru hiperpolarizare într-un cadru clinic. În: RMN în biomedicină. Februarie 2013, volumul 26, nr. 2, pp. 124-131. doi: 10.1002 / nbm.2827.
- ^ C. Russell Bowers, Daniel P. Weitekamp: Transformarea ordinii de simetrizare la magnetizarea spinului nuclear prin reacție chimică și rezonanță magnetică nucleară . În: Scrisori de revizuire fizică . bandă 57 , nr. 21 noiembrie 1986, pp. 2645-2648 , doi : 10.1103 / PhysRevLett.57.2645 .
- ↑ Imagini clare cu câmpul magnetic al pământului. Arhivat din original la 14 august 2016 ; accesat pe 14 august 2016 .
- ^ Daniel A. Horke, Yuan-Pin Chang, Karol Długołecki și Jochen Küpper: Separarea apei para și orto. În: Angewandte Chemie. 2015 , 126, pp. 12159–12162, doi : 10.1002 / anie.201405986 .
- ↑ a b Ardita Kilaj, Hong Gao, Daniel Rösch, Uxia Rivero, Jochen Küpper & Stefan Willitsch: Observarea diferitelor reactivități ale para și orto-apei către ionii de diazeniliu prinși. În: Nature Communications. 2018 , 9, p. 2096, doi : 10.1038 / s41467-018-04483-3 .