Chimotripsina B
| Chimotripsina B | ||
|---|---|---|
| ||
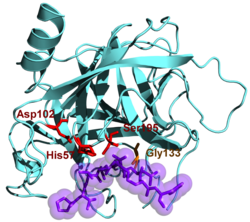
| Model de panglică de chimotripsină conform PDB 4cha . Se evidențiază triada catalitică - aspartat-102, histidină-57, serină-195 - și o secțiune a inhibitorului eglin C (violet) | ||
| Proprietățile proteinelor umane | ||
| Structura primară de masă / lungime | 241 = 13 + 131 + 97 AA | |
| Precursor | Chimotripsinogen B (245 AA) | |
| Identificator | ||
| Numele genei | CTRB1 | |
| ID-uri externe | ||
| Informații despre droguri | ||
| Codul ATC | B06 AA04 , S01 KX01 | |
| Clasificarea enzimelor | ||
| CE, categorie | 3.4.21.1 , serină protează | |
| MEROPS | S01.152 | |
| Substrat | Tyr - + - Xaa, Trp - + - Xaa, Phe - + - Xaa, Leu - + - Xaa | |
| Apariție | ||
| Familia de omologie | Tripsină | |
| Taxon părinte | Făptură | |
Chimotripsina B este o enzimă digestivă care are o structură foarte asemănătoare cu tripsina , dar diferă de aceasta în special prin efectul său de coagulare a laptelui. Chimotripsinele umane B și C aparțin serin proteazei și sunt aproape identice la mamiferele superioare . Au fost identificate mai multe alte chimotripsine din viața marină și insecte.
Chimotripsina B este produsă în pancreas sub forma unui precursor zimogen inactiv (chimotripsinogen). Chimotripsinogenul este împărțit în trei subunități de tripsină în intestinul subțire , iar ansamblul subunităților îl transformă în forma activă (chimotripsina).
poveste
Moses Kunitz (1887–1978) și John Howard Northrop au produs chimotripsină în formă cristalină în 1935; În 1947, C. Jacobsen a realizat că au existat diferite modificări .
În 1962 TL Shields l-a folosit pentru terapia herpesului zoster și A. Rosanova a obținut, de asemenea, succes în 1967 în tratamentul herpesului zoster, pneumoniei virale și gripei .
Utilizare în medicină
Ca ingredient activ, chimotripsina face parte din preparatele enzimatice care sunt utilizate pentru tromboflebită și alte inflamații.
De asemenea, este utilizat local în oftalmologie ca proteolitic .
Determinarea chimotripsinei în scaun poate oferi informații despre diferite boli ale pancreasului, în special insuficiența pancreatică exocrină . Determinarea elastazei pancreatice în scaun este considerată a fi mai sensibilă .
biochimie
Chimotripsina B se clivează de preferință la legături peptidice a căror grupare carbonil este derivată dintr-un aminoacid aromatic ( L - tirozină , L - triptofan sau L - fenilalanină ) sau din L - leucină . Este una dintre endopeptidaze . Datorită mecanismului de acțiune cu triada catalitică a L - aspartatului , L - histidinei și L - serinei , aceasta este atribuită serinei proteazei .
Acești trei aminoacizi polari, care sunt foarte conservați în serina protează, se găsesc și în tripsină și elastază .
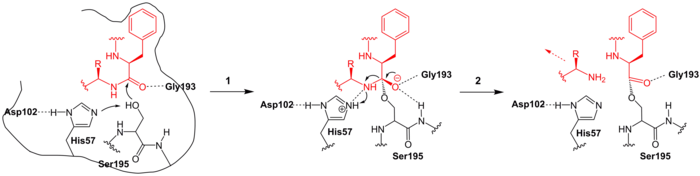
Un mecanism enzimatic probabil este prezentat în figurile de mai jos. Polipeptida care trebuie clivată se leagă de chimotripsina B, prin care aminoacidul hidrofob conținut în substrat (o fenilalanină , roșie în figură ) ajunge la un buzunar de legare. Aceasta este stabilizată și de glicină (Gly193) prin legături de hidrogen .
În prima etapă de reacție ( 1 ), serina catalitică (Ser195) atacă legătura peptidică care urmează să fie clivată prin atac nucleofil . Histidina-57 (His-57) acționează aici ca bază deoarece elimină un proton din Ser195. Aceasta creează o stare de tranziție tetraedrică de scurtă durată în care are loc apoi o decolteu legătură de restul peptidei substratului ( 2 ). Aceasta lasă enzima. Intermediarul acil-enzimă rămas, totuși, este stabil și poate fi, de asemenea, izolat cu ajutorul analogilor substratului.
Când apa este stocată (pasul 3 , albastru), aceasta reacționează ca agent nucleofil și atacă carbonul carbonilic al intermediarului. His57 acționează ca bază și preia un proton din apă. Se formează din nou o stare de tranziție tetraedrică ( 4 ). Aceasta este de scurtă durată ( 5 ). Aceasta eliberează polipeptida rămasă și, ca rezultat, regenerează Ser195. Un nou ciclu poate începe.
Dovezi individuale
- ^ A b c Wolf-Dieter Müller-Jahncke , Christoph Friedrich , Ulrich Meyer: Istorie medicală . Ediția a doua, revizuită și extinsă. Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart 2005, ISBN 978-3-8047-2113-5 , p. 115 .
- ↑ Olav Hagemann: Chimotripsina în scaun. În: laborlexikon.de. Adus la 23 noiembrie 2016 .
- ↑ Albert Gossauer: Structura și reactivitatea biomoleculelor: o introducere în chimia organică . Helvetica Chimica Acta / Wiley-VCH 2006; ISBN 978-3-906390-29-1 ; P. 453.
- ^ Reginald Garrett și Charles M. Grisham: Biochimie . (International Student Edition). Thomsom Learning Inc.; Ediția a III-a 2005; ISBN 0-534-41020-0 ; P. 434ff.
Link-uri web
- Jennifer McDowall / Interpro: Proteina lunii: Tripsină și chimotripsină. (engl.)