Oxihidrogen

Gazul electrolitic , cunoscut și sub numele de oxihidrogen sau HHO în țările vorbitoare de limbă engleză , este un gaz mixt exploziv format din hidrogen (H 2 ) și oxigen (O 2 ). Când intră în contact cu un foc deschis (tăciuni sau scântei), are loc așa-numita reacție oxihidrogenă. Un amestec finit de hidrogen și oxigen într-un raport molar de 2: 1 este exploziv chiar și în cantități mici. Dacă, pe de altă parte, se folosește numai hidrogen ca produs de pornire și este amestecat cu aer sub presiune atmosferică, fracția volumică a hidrogenului trebuie să fie între 18 și 76 % în volum . Dacă aceste valori limită scad sau se depășesc, nu se mai produce o explozie / detonare . Amestecurile de aer și 4 până la maxim 18% vol hidrogen sunt, de asemenea, inflamabile, dar nu explozive. O flacără continuă cu gaz oxidrogen poate fi obținută prin arderea controlată la o duză de amestecare .
Formarea oxihidrogenului a fost observată în secolul al XVII-lea de Théodore Turquet de Mayerne (în jurul anului 1620) și Robert Boyle (în jurul anului 1670) prin acțiunea acizilor asupra metalelor. Henry Cavendish și Joseph Priestley au urmat în anii 1770 și 1780 .
de fabricație
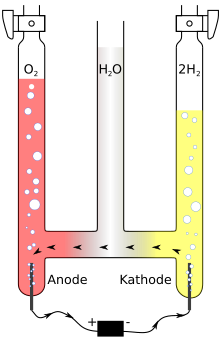
Oxihidrogen poate fi produs prin electroliza apei , adică descompunerea electrolitică a apei (H 2 O) sau prin termică descompunerea apei. Descompunerea termică a apei necesită temperaturi peste 2500 ° C.
În cazul electrolizei apei , divizarea are loc cu ajutorul curentului electric . Electrozii sunt scufundați în apă, iar conductivitatea electrică poate fi îmbunătățită enorm prin adăugarea unui acid sau a unei baze . Pentru a reduce riscul de aprindere neintenționată, gazele care clocotesc din cei doi electrozi - adică hidrogenul peste catod (polul negativ) și oxigenul peste anod (polul pozitiv) - sunt colectate într-o așa-numită descompunere a apei Hofmann aparat .
Reacție oxidrogen
Reacția oxihidrogen este exotermă și detonarea asemănătoare reacția hidrogenului cu oxigen si ruleaza la o detonație viteză de 2,820 m / s. Este o formă de combustie ( oxidare ) și deseori o explozie .
Reacție Ecuația este:
Este o reacție în lanț foarte ramificată care implică hidrogen, oxigen și hidroxil - radicali ca purtător de lanț.
și alte reacții
Produsul de reacție este apa .
Conversia energiei eliberate pe formula molară este de 571,6 kJ / mol (Δ r H 0 = −571,6 kJ / mol). Aceasta schimbă entalpia H pentru un mol din apa rezultată cu -286 kJ / mol.
În plus, se produce peroxid de hidrogen :
Reacția oxihidrogen este puternic dependentă de presiune și temperatură. La presiuni foarte mici, purtătorii de lanț rezultați pot ajunge la peretele vasului și se pot recombina acolo. Acest lucru previne prelungirea sau ramificarea lanțului și previne o explozie. Dacă presiunea crește, amestecul atinge limita inferioară de explozie. Calea liberă medie a devenit acum atât de mică încât purtătorii de lanț se ciocnesc cu alte particule înainte de a ajunge la pereții vasului și de a continua reacția în lanț. Dacă presiunea crește în continuare, sistemul atinge limita superioară de explozie. Presiunea ridicată crește probabilitatea coliziunilor cu trei particule, astfel încât purtătorii de lanț se pot recombina și în faza gazoasă și reacția în lanț se întrerupe. La presiuni și mai mari, are loc în cele din urmă o explozie termică. Aici energia eliberată în timpul reacției nu mai poate fi disipată suficient de repede și temperatura reacției este crescută. Acest lucru duce la reacții suplimentare, a căror energie nu mai poate fi disipată. Explozia termică se bazează pe o creștere drastică a temperaturii și nu pe o reacție de ramificare în lanț.
În celulele eucariote care trăiesc în mitocondrie , oxidarea finală în complexul IV din lanțul respirator duce la o reacție exergonică analogă, dar strict controlată (ocazional, nu destul de corect, denumită „reacție biologică oxihidrogenă”). H. formarea moleculelor de ATP servește:
Liberă entalpiei AG ° „de reacție rezultatele sale potențial redox (+0,5 V) , cât și în condiții fiziologice (pH 7) este de -193 kJ / mol.
Aceeași reacție are loc și în celula de combustibil . În construcția lor, energia eliberată în timpul reacției oxihidrogen ( diferență de entalpie ), aici mai precis: entalpia liberă sau energia Gibbs ΔG, este utilizată fără a provoca o explozie . Entalpia care este eliberată este eliberată parțial ca curent electric și parțial ca căldură. Cu toate acestea, reacția din celula de combustibil are loc lent și într-un mod controlat.
Probă de oxigen hidrogen
În chimie, termenul eșantion oxidrogen denotă dovezi de hidrogen . Cu toate acestea, acest lucru este nespecific, deoarece z. B. metanul formează un amestec exploziv cu oxigen și, prin urmare, este utilizat numai pentru a demonstra explozia. O modalitate sigură de a detecta oxihidrogenul este verificarea raportului de amestecare, care este de obicei ușor de făcut doar cu aparate închise la scară mică.
Pentru detectare, gazul care trebuie verificat este de obicei ținut într-o eprubetă cu deschiderea orientată în jos, astfel încât hidrogenul să nu poată scăpa din cauza densității sale mai mici decât aerul, lângă o sursă de aprindere - cum ar fi un arzător Bunsen sau o brichetă .
Cazul 1: Gazul colectat este hidrogen pur . Există o combustie calmă sau, eventual, o deflagrație slabă (eșantion negativ de gaz oxidrogen).
Cazul 2: Gazul colectat este un amestec de hidrogen și oxigen (oxihidrogen). Arderea are loc cu un zgomot șuierător (probă pozitivă de gaz detonant).
Datorită diferitelor zgomote de hidrogen pur și a amestecului de hidrogen și oxigen, proba de oxidrogen este de asemenea utilizată pentru a verifica puritatea hidrogenului gazos pentru a evita o explozie într-un vas închis.
Un amestec gazos reactiv similar de hidrogen și clor este cunoscut sub numele de gaz detonant al clorului .
utilizare
Johann Wolfgang Döbereiner a descoperit că reacția oxihidrogenă poate fi pusă și în mișcare folosind un fir de platină ca catalizator . Câțiva ani mai târziu, el a reușit să aprindă un amestec oxigenat gazos sub influența unui burete de platină . Această descoperire a dus la inventarea primei brichete ( bricheta platină Döbereiner ).
În zilele noastre, un amestec de hidrogen și oxigen este, de asemenea, utilizat în aplicații tehnice (pentru sudare și tăiere) în așa-numitele suflante oxidrogen, care pot atinge o temperatură a flăcării de până la aproximativ 2000 ° C (un tip de dispozitiv de sudare cu combustibil oxigenat) ). Una dintre primele astfel de suflante a fost „ Daniellsche Hahn ” din 1833.
Accidente
Au existat deja numeroase accidente în întreaga lume datorate exploziilor de oxihidrogen, unele dintre ele catastrofale.
Accidentul Hindenburg Zeppelin din 1937, adesea citat ca exemplu , în care hidrogenul gazos a scăpat în atmosfera aerului printr-o scurgere minoră la apropierea de catargul de ancorare, provocând un incendiu imens de hidrogen, nu a fost o reacție oxihidrogenă deoarece fracțiunea de volum de hidrogen era prea mare și concentrația de oxigen din aer prea mică.
Mai recent, exploziile de hidrogen au devenit deosebit de cunoscute în timpul dezastrului de la Cernobîl în 1986 și al dezastrului nuclear de la Fukushima în 2011 .
literatură
- Gerhart Jander, Hans Spandau, Jürgen Fenner, Rolf Minkwitz: Scurt manual de chimie anorganică și generală. Ediția a 10-a, Springer, Berlin / Heidelberg 1987, ISBN 978-3-540-16749-5 .
- Peter W. Atkins, Julio de Paula: Scurt manual de chimie fizică . Ediția a IV-a. Wiley-VCH, Weinheim 2008, ISBN 978-3-527-31807-0 , pp. 512-513 .
Dovezi individuale
- ↑ Bazele chimiei anorganice I: elemente principale ale grupului (PDF; 722 kB), 2003.
- ↑ Peter W. Atkins, Julio de Paula: Scurt manual de chimie fizică . Ediția a IV-a. Wiley-VCH, Weinheim 2008, ISBN 978-3-527-31807-0 , pp. 512-513 .
- ^ Catastrofe aeriene , Gondrom-Verlag (ed.), 1996.