Lanț respirator

| Mamă |
|
Lanțul de transport al electronilor Respirația celulară Fosforilarea oxidativă |
| Subordonat |
| Lanțul respirator al membranei celulare Lanțul respirator al membranei mitocondriale |
| Ontologie genică |
|---|
| QuickGO |
| Mamă |
|
Membrana celulară membrana mitocondrială |
| Subordonat |
|
Complex I Complex II Complex III Complex IV |
| Ontologie genică |
|---|
| QuickGO |
Lanțului respirator este parte a metabolismului energetic al majorității lucrurilor vii . Pe de o parte, termenul de lanț respirator denotă o cale metabolică , și anume un lanț de reacții redox biochimice care au loc una după alta , pe care ființele vii le folosesc pentru a genera energie și, pe de altă parte, și întregul complexelor proteice. participând la calea metabolică .
Lanțul respirator este un caz special al unui lanț de transport al electronilor și, împreună cu chimiozmoza, formează procesul de fosforilare oxidativă .
Electronii furnizați de NADH , FMNH 2 și FADH 2 sunt transferați la un agent oxidant într-o serie de procese redox . Deci - în special cu eucariote - reacția exergonică a hidrogenului (H 2 ) și a oxigenului (1/2 O 2 ) la apă este împărțită în etape individuale. În loc de o dezvoltare a căldurii potențial explozive , energia eliberată este utilizată pentru a sintetiza „moneda energetică” universală a celulei , ATP , din ADP și fosfat ( fosforilare oxidativă ). Hidrogenul și purtătorii de electroni NADH și FADH 2 electroni legați și hidrogenul legat de aceștia provin din oxidarea donatorilor externi de electroni, de exemplu - prin intermediul ciclului Krebs - degradarea acizilor grași și glicoliză .
În eucariote, lanțul respirator este situat în membrana interioară a mitocondriilor , în procariote în membrana celulară . Există, de asemenea, alți donatori de electroni decât grăsimile și zaharurile și alți acceptori de electroni decât oxigenul.
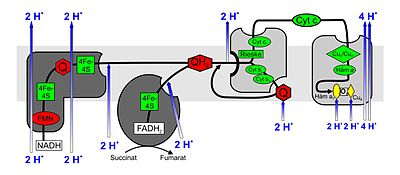
Lanțul respirator ca lanț de transport al electronilor
Lanțurile de transport ale electronilor constau dintr-o serie de molecule redox conectate în serie care sunt capabile să accepte sau să elibereze electroni. Prin acest lanț, electronii sunt transferați de la niveluri de energie superioare la niveluri inferioare, cad în jos, ca să spunem așa, în trepte, prin care moleculele redox individuale au un nivel de energie din ce în ce mai scăzut. În eucariote, complexele enzimatice I-IV și purtătorii de hidrogen sau de electroni ubiquinonă (coenzima Q) și citocromul c , care sunt încorporate în membrana mitocondrială internă, sunt implicate în lanțul de reacție . Proteinele implicate în lanțul de transport al electronilor (complexele I - IV) și purtătorii de electroni ubiquinonă și citocrom c formează un sistem redox (complex) .
Transportul electronilor este asociat cu absorbția și eliberarea protonilor. Prin organizarea spațială a acestor procese sau prin intermediul unor modificări conformaționale în structura proteinelor cauzate de fluxul de electroni , protonii (H + ) sunt „transportați” (reali sau ca efect net). Acest lucru creează un „ gradient electrochimic de protoni ” (compus din diferența de concentrație a protonilor și potențialul negativ al membranei în interiorul mitocondriilor generat de îndepărtarea protonilor încărcați pozitiv). Energia acestui „gradient electrochimic de protoni” ( forța motivă a protonului , „pmf”) este utilizată de o sintază ATP prin difuzia posterioară a protonilor în membrana mitocondrială internă , conform teoriei chimiosmotice acceptate acum în general de Peter D. Mitchell , ATP din ADP și anorganice Pentru sintetizarea fosfatului (în cazuri rare și fructoză). Această fosforilare se numește fosforilarea lanțului respirator sau fosforilarea oxidativă (abrevierea: Oxphos ) datorită cuplării la lanțul respirator .
Funcțiile complexelor lanțului respirator
În plus față de membrana sa exterioară , o mitocondrie conține și o membrană interioară . Spațiul dintre aceste două membrane se numește spațiul intermembranar (spațiul perimitocondrial).
Trei dintre cele patru complexe ale lanțului respirator acoperă fiecare membrana mitocondrială internă complet (integral), în timp ce complexul II se termină „orb” (periferic). O diferență de concentrație de protoni este generată între spațiul intermembranar și interiorul ( matricea ) mitocondriei, care este apoi utilizat în sintaza ATP pentru sinteza ATP.
Complexul I.
NADH: ubiquinonă oxidoreductază sau NADH dehidrogenază . Acest complex enzimatic imens (940 kDa ) redus de NADH , în special din ciclul acidului citric , ubiquinonă (UQ sau Q) pentru Ubihidrocinonă, de asemenea, ubiquinol (UQH 2 sau QH 2 dat). Complexul este format din două părți care împreună creează forma sa caracteristică de L. Nucleotidele care conțin flavină ( FMN ) și centrele de fier-sulf sunt necesare ca grupe protetice într-o unitate pentru a cataliza reacția redox. Datorită transportului de electroni asociat cu reacțiile redox, 3-4 protoni per NADH oxidat sunt pompați în spațiul intermembranar. Se presupune că cuplarea cu transportul protonului are loc printr-o schimbare conformațională a enzimei.
Complexul II
Succinat: ubiquinonă oxidoreductază sau succinat dehidrogenază . Complexul II este enzima succinat dehidrogenază din ciclul acidului citric. În timpul reacției în ciclul acidului citric, succinatul este oxidat până la fumarat . FAD este un grup protetic din enzimă. Acesta își transferă electronii din complexul II către ubiquinonă, care este redusă la ubihidrochinonă. Complexul II conține, de asemenea, centre de fier-sulf, cum ar fi complexul I; cu toate acestea, niciun proton nu este pompat în spațiul intermembranar.
Complexul III
Ubihidrochinonă (ubiquinol): citocrom c oxidoreductază sau citocrom c reductază . La complexul III, ciclul Q contribuie la generarea diferenței de concentrație a protonilor prin absorbție asimetrică și eliberare de protoni. În timpul oxidării ubiquinolului (QH 2 ) la ubiquinonă (Q), o moleculă de citocrom c este redusă într-un ciclu pentru fiecare electron eliberat (din ubiquinol) și doi protoni sunt eliberați în spațiul intermembranar. Al doilea electron reduce o altă ubiquinonă la un alt loc de legare de pe matricea mitocondrială, mai întâi la ubisemiquinonă radicală liberă (QH), apoi la QH 2 , prin care doi protoni sunt absorbiți din matrice.
După cele două semicicluri, patru protoni pe moleculă de ubiquinol sunt eliberați în spațiul intermembranar, doi protoni sunt eliminați din matricea mitocondrială și doi citocrom c sunt reduși. În complexul III, are loc o deviere de la un transportor cu doi electroni (ubiquinol) la un transportor cu un singur electron (citocrom c ).
Complexul IV
Citocrom c : O 2 oxidoreductaza sau citocrom c oxidază . În complexul IV, citocromul c este oxidat și oxigenul este redus la apă. Energia eliberată este utilizată pentru a proteja din spațiul matricei din pompa spațială intermembranară .
La complexul IV, citocromul c este oxidat și un electron este transferat în complex. După transferul succesiv de patru electroni (e - ), o moleculă de oxigen legată poate fi redusă la două molecule de apă (H 2 O). Cei patru protoni (H + ) necesari pentru aceasta sunt retrași din matrice. Energia eliberată în timpul reducerii oxigenului în apă este utilizată de enzimă pentru a pompa încă patru protoni pe moleculă de oxigen din matrice prin membrana mitocondrială internă în spațiul intermembranar. Acest lucru se întâmplă prin schimbări ale structurii spațiale: într-o conformație, o proteină are o afinitate mare pentru H + și, prin urmare, acceptă un proton. În conformația opusă există o afinitate scăzută și protonul este eliberat în exteriorul membranei.
Citocromul c oxidaza este o proteină transmembranară cu două hem un molecule (hem o și hem a 3 ) ca grupări prostetice și două cupru centre (Cu A și Cu B ) ca cofactori . Enzima este responsabil pentru aproape toate consumul de oxigen (formarea de apă de oxigen și hidrogen în lanțul respirator) al tuturor organismelor de respirat cu oxigen.
Inhibitori ai lanțului respirator

Au fost identificați o serie de inhibitori care inhibă lanțul de transport al electronilor în diferite puncte:
- Rotenona și amobarbitalul (Amytal) inhibă complexul I (NADH oxidază). Cu toate acestea, deoarece transferul de electroni de la FADH2 la complexul II nu este influențat, fosforilarea oxidativă poate avea loc în continuare.
- Malonatul și un număr de fungicide (SDHI) inhibă complexul II (succinat dehidrogenază).
- Antibioticul antimicină A inhibă complexul III (citocrom c reductază); blochează transferul de electroni de la citocromul b la citocromul c1 ; componentele lanțului respirator din fața locului de acțiune al antimicinei A din complexul III rămân reduse, toate din spate rămân oxidate. Aceasta inhibă consumul de oxigen în complexul IV și sinteza ATP în complexul V. Fungicidele din clasa strobilurinelor inhibă, de asemenea, complexul III în punctul Q o .
- Cianurile , azidele și monoxidul de carbon inhibă complexul IV (citocrom c oxidază); aceste molecule blochează locul de legare pentru oxigen . Ca urmare, acest lucru duce la o acumulare de electroni, în urma căreia componentele lanțului respirator sunt complet reduse și lanțul respirator se oprește. Intoxicația cu cianură face ca venele să apară roșii, deoarece oxigenul din hemoglobina din arteriole nu se poate difuza în celule, deoarece nu este consumat acolo. Așa ajunge sângele bogat în oxigen în vene.
- antibioticul oligomicină inhibă ATP sintaza prin legarea la rețeaua sa (partea F o , o pentru oligomicină sensibilă), ceea ce înseamnă că gradientul de protoni este descompus mult mai lent. Ca urmare, fluxul de electroni pentru a menține acest gradient scade semnificativ, iar consumul de oxigen scade. Oligomicina acționează și ca decuplator. În literatura relevantă, nu se face nicio distincție între F 0 (zero) și F o .
- Biguanidele, cum ar fi medicamentul împotriva diabetului, metformina acționează probabil prin inhibarea complexului I.
Toți inhibitorii menționați anterior ai lanțului respirator duc la un consum redus de oxigen. Inhibitorii, cunoscuți ca decuplători, se comportă diferit.
Decuplarea lanțului respirator
Decuplatoarele ( protonofori ) reduc potențialul membranei mitocondriale (gradientul protonului). Procedând astfel, ele întrerup legătura dintre oxidare și fosforilare. Ca rezultat, transportul electronilor și funcționarea complexelor I-IV au loc complet, dar gradientul de protoni acumulat în timpul acestui proces este anulat de decuplator. Aceasta înseamnă că nu poate apărea nicio sinteză a ATP. Deoarece protonii nu mai trebuie translocați împotriva unui gradient electrochimic, etapele de oxidare din complexele I-IV rulează mult mai repede. În același timp, acest lucru duce la un consum crescut de oxigen.
- decuplatoare naturale:
- Termogenină , vezi și țesutul adipos maro .
- decuplatoare artificiale:
- 2,4-Dinitrofenolul este un acid slab. Este protonat peste membrana mitocondrială internă datorită abundenței ionilor H + ( pH mai mic ), poate trece apoi prin membrană și este deprotonat intramitocondrial (pH mai mare).
- Cianură de carbonil-m-clorfenilhidrazonă (CCCP)
- Cianură de carbonil p- trifluorometoxifenilhidrazonă (FCCP)
- Pentaclorofenol (PCP)
literatură
- M. Saraste: Fosforilarea oxidativă la capătul de secol . În: Știință , Vol. 283, 1999, Nr. 5407, pp. 1488-1493, PMID 10066163 .
- Löffler, Petrides: Biochimie umană . Ediția a VII-a.
Link-uri web
- Fosforilarea oxidativă - Calea de referință . KEGG (reprezentare grafică a complexelor lanțului respirator mitocondrial, engleză)
- Căi mitocondriale: fosforilarea oxidativă . (Engleză)
- Pedro Silva: Logica chimică din spatele ... Respirației și fermentației . (Engleză)
- Lanțul de transport al electronilor (ilustrație animată)
- Lanțul de transport al electronilor . Jassal / reactom
Dovezi individuale
- ↑ a b Bruce Alberts și colab.: Biologia moleculară a celulei . Ediția a IV-a. New York 2002, pp. 773-793
- ↑ RG Efremov, R. Baradaran, LA Sazanov: Arhitectura complexului respirator I. În: Natura . Volumul 465, numărul 7297, mai 2010, pp. 441-445, doi: 10.1038 / nature09066 . PMID 20505720 .
- ↑ JM Berg, JL Tymoczko, L. Stryer: Biochimie . Ediția a 6-a. Spektrum-Verlag, 2007.
- ↑ Bruce Alberts și colab.: Biologia moleculară a celulei . Ediția a IV-a. New York 2002, p. 791
- ↑ Todd A. Swanson, Sandra I. Kim, Marc J. Glucksman: BRS Biochimie, Biologie moleculară și genetică . Ediția a 5-a. Lippincott Raven, 2010, ISBN 978-0-7817-9875-4 , p. 89.
- ↑ LS Huang, D. Cobessi și colab.: Legarea antimicinei inhibitorului lanțului respirator la complexul bc1 mitocondrial: o nouă structură cristalină dezvăluie un model de legătură de hidrogen intramolecular modificat. În: Jurnal de biologie moleculară . Volumul 351, numărul 3, august 2005, pp. 573-597, doi: 10.1016 / j.jmb 2005.05.053 . PMID 16024040 . PMC 1482829 (text complet gratuit).
- ↑ HR Bridges, VA Sirviö și colab.: Caracteristicile moleculare ale biguanidelor necesare pentru țintirea complexului respirator mitocondrial I și activarea AMP kinazei. În: biologia BMC. Volumul 14, august 2016, p. 65, doi: 10.1186 / s12915-016-0287-9 , PMID 27506389 , PMC 4977651 (text complet gratuit).