adsorbţie
Deoarece adsorbția (din latină adsorptio din adsorbere "(an) suge") se referă la îmbogățirea substanțelor din gaze sau lichide la suprafața unui corp solid, mai general la interfața dintre două faze .
Aceasta diferă de absorbție , în care substanțele pătrund în interiorul unui solid sau al unui lichid. Termenul generic pentru adsorbție și absorbție este absorbția .
Dacă două sau mai multe specii se adsorb pe o suprafață, aceasta se numește coadsorbție . Acest lucru este deosebit de important în cazul catalizatorilor , în care diferitele tipuri de atomi sunt adsorbiți pe aceeași suprafață și reacționează acolo.
Delimitare
În sens general, adsorbția este un proces fizic în care substanțele (de obicei molecule) se lipesc de suprafața altei substanțe și se acumulează pe suprafața acesteia. Forțele care determină atașarea nu sunt legături chimice , ci doar forțe van der Waals . Prin urmare, această formă de adsorbție se numește mai precis adsorbție fizică sau fizizorbție . Adsorbție fizică principiu include , de asemenea, procesul inverse, desorbția , ca sistem tinde întotdeauna un echilibru între adsorbția și desorbția unei substanțe. Suprafața pe care are loc adsorbția poate fi suprafața unui solid sau suprafața unui lichid. În general, suprafețele se numesc interfețe . Faza din care substanța atinge interfața poate fi o fază gazoasă sau (lichid soluție ). Particulele ajung la interfață prin mișcarea lor moleculară , direcționată termic . Cu toate acestea, următoarele secțiuni descriu în principal adsorbția gazelor pe suprafețe solide. Physisorption este lângă Ab sorbția un proces de zi cu zi și se desfășoară pe aproape toate suprafețele care gazele (aer) sau temperaturi ale lichidului (apa).
În cazul special al adsorbției chimice , cunoscut și sub numele de chemisorbție , substanțele sunt legate de suprafața unui solid prin legături chimice. Chemisorbția poate avea consecințe considerabile pentru substanța adsorbită și, prin urmare, diferă de fizizorbție. Prin ruperea și formarea legăturilor chimice, se pot forma alte substanțe și o substanță desorbită (desorbat) poate fi produsul unei reacții chimice. De regulă, în chemisorbție apar călduri de reacție ridicate, care pot fi folosite ca criteriu pentru diferențierea dintre fizorbție și chimișorbție. Chemisorbția nu este adesea o reacție de echilibru, adică ireversibilă, poate avea loc numai la temperaturi ridicate și adesea nu duce la o acumulare de substanțe la suprafață. Chimiisorptiile sunt etape importante care apar în procesele de cataliză eterogene .
În general, termenul de adsorbție trebuie utilizat numai pentru procesele zilnice de fizorbție . Adsorbțiile speciale cu procese chimice ar trebui denumite în mod explicit chemisorbție .
Adsorbția fizică
| Adsorbția fizică | |
| Monostrat | Energie de adsorbție |
|
|
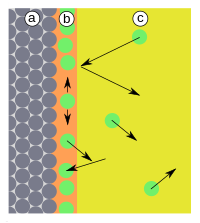
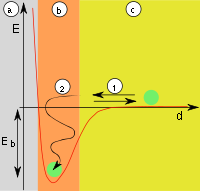
| Fig.1: a) adsorbant, b) adsorbat la interfață, c) faza gazoasă sau soluție cu adsorptiv | Fig.2: a) adsorbant, b) adsorbat, c) faza gazoasă, d-distanță, E-energie, E b- energie de absorbție, (1) reflexie, (2) adsorbție |
| Monostrat și condens | selectivitate |
|
|
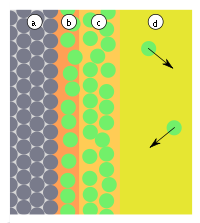
| Fig.3: a) adsorbant, b) adsorbat, c) condensat d) fază gazoasă sau soluție cu adsorbție | Fig.4: a) adsorbant, b) adsorbat, c) faza gazoasă sau soluție cu adsorbtiv diferit: Moleculele în albastru sunt preferabil adsorbite aici |
| Suprafață dură | Suprafața interioară |

|
|
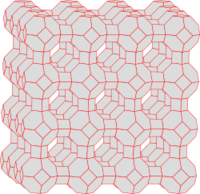
| Fig.5: a) Adsorbant cu o suprafață rugoasă b) Adsorbat, c) Faza gazoasă sau soluție cu adsorbție | Fig.6: Structura zeolitului A cu o suprafață interioară mare |
Adsorbție fizică ( physisorption ) a unei substanțe pe o suprafață este similară cu o reacție de echilibru chimic. Cu toate acestea, substanța adsorbită (adsorbat) nu formează o legătură chimică cu suprafața , dar aderă din cauza forțelor mai slabe similare aderenței . De regulă, apar doar forțele Van der Waals . Energia de adsorbție în fizorbție este în intervalul de la 4 la 40 kJ / mol. Legăturile chimice dintr-o particulă adsorbită rămân, dar se polarizează . Pentru această reacție de echilibru se poate stabili o ecuație de reacție între substanța care este adsorbită (adsorbtivă), suprafața solidului (adsorbant) și adsorbatul:
Se aplică următoarele:
- - Particule în fază gazoasă sau în soluție (adsorbtive)
- - particule la suprafață (adsorbat)
- - Suprafețe libere ale adsorbantului
Dacă particulele lovesc suprafața (Fig. 1), ele sunt fie reflectate, fie adsorbite. Adsorbția are loc atunci când particulele își pot elibera energia cinetică și energia de adsorbție ( E b ), care este eliberată sub formă de căldură (Fig. 2). Reacția este deci exotermă . Adsorbția este reversibilă, deoarece particulele pot părăsi suprafața cu o cantitate similară de energie, deoarece aceste reacții nu sunt de obicei inhibate de stările de tranziție . Prin urmare, energia de activare ( E a ) a reacției este egală cu energia de adsorbție ( E b ). Particulele adsorbite nu au un loc fix de legare la suprafață, nu rămân în punctul în care au fost adsorbite, ci se mișcă liber de-a lungul suprafeței.
Poziția echilibrului depinde de proprietățile și dimensiunea suprafeței, de proprietățile și presiunea (sau concentrația) adsorbției, precum și de temperatură. La 300 ° C și presiuni normale, echilibrul este adesea până la stânga. Dacă echilibrul este complet pe dreapta, particulele din faza gazoasă formează în mod ideal un strat monomolecular la suprafață.
În practică, se pot forma straturi suplimentare după formarea monostratului (Fig. 3). Strict vorbind, se numără doar formarea primului strat pentru adsorbție, deoarece doar aici interacțiunile dintre suprafață și actul adsorptiv. În celelalte straturi există doar interacțiuni între adsorbați. Strict vorbind, este atunci o chestiune de condensare a adsorptivilor. Căldura de condensare (legarea de energie a adsorbați una de alta) , este de obicei semnificativ mai mic decât energia de adsorbție a unui adsorbat adsorbant.
De regulă, suprafețele adsorbanților nu au o structură ideală plană, ci mai degrabă prezintă numeroase defecte ( defecte de rețea ). Aceste defecte formează locuri în care adsorbatul este legat în mod special strâns (fig. 5). Mobilitatea adsorbatului permite ca aceste site-uri să fie ocupate indiferent de site-ul în care adsorbtivul a fost adsorbit. Prin urmare, performanța unui adsorbant crește cu numărul defectelor sale. Din acest motiv, cărbunele activ în mare parte amorf este un adsorbant deosebit de puternic în comparație cu grafitul . Alte substanțe performante, cum ar fi zeoliții , nu sunt amorfe, dar au un sistem de canale foarte îngust (Fig. 6), așa-numita suprafață interioară , în care doar câteva molecule (adsorbtive) pot fi plasate una lângă alta. Cu astfel de substanțe, adsorbția și condensarea se disting cu greu. Ocazional, astfel de procese se mai numesc și condensare capilară (vezi capilaritate ).
Suprafețele sunt întotdeauna acoperite de substanțe în condiții normale. Moleculele solventului stau pe suprafața solidelor în contact cu solvenții. Suprafețele în contact cu aerul sunt de ex. B. ocupat cu molecule de apă. Adsorbanții practici potriviți se caracterizează prin selectivitate (Fig. 4). Substanțele dizolvate din soluții înlocuiesc solvenții și anumite substanțe din aer înlocuiesc apa de la suprafață, deoarece acestea sunt mai puternic legate (deplasare de adsorbție ). Această acumulare a anumitor substanțe la suprafață permite producerea de filtre de gaze (de exemplu, în filtre de protecție respiratorie ) și metode de cromatografie de adsorbție .
Izotermă de adsorbție
| Izotermă de adsorbție | |
| strat monomolecular | |
| |
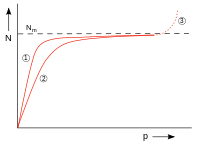
| Fig. 7: N: numărul de particule adsorbite, p: presiune, N m : numărul de particule când suprafața este complet acoperită, (1) și (2) izoterme de adsorbție pentru două temperaturi; temperatură mai mare cu (2), (3) condens | |
| Condensarea capilară | |
| |
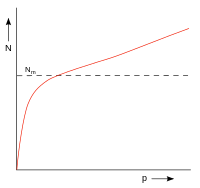
| Fig. 8: Comportamentul de adsorbție a materialelor cu pori mari / pori gros, cum ar fi silicagel | |
Un grad de acoperire a suprafeței poate fi definit pentru adsorbția straturilor monomoleculare :
- , Cu
- : Numărul de molecule adsorbite
- : Numărul de molecule când este complet ocupat
Gradul de ocupare într-un sistem de suprafață gaz - solid depinde de presiunea parțială a gazului și de temperatură .
Pentru caracterizarea (măsurarea) suprafețelor substanțelor, sunt de preferință înregistrate așa-numitele izoterme de adsorbție , la care temperatura este menținută constantă. Gazele precum azotul sau gazele nobile sunt adesea folosite ca adsorbați. Poziția echilibrului unui sistem depinde atunci doar de presiune.
O izotermă practic importantă este izoterma Langmuir , care poate fi reprezentată în această formă:
Mărimea poate fi privită ca raportul dintre constantele ratei de desorbție și adsorbție a unui sistem. Figura 7 prezintă cursul ocupării. Pentru mici ( ) izoterma de adsorbție este proporțională cu . Pentru mari ( ) curba se apropie de ocuparea monomoleculară . Condensarea apare la presiuni mai mari, dar acest lucru nu este descris de izoterma Langmuir.
Pe lângă izoterma de adsorbție a lui Langmuir, adsorbția chimică poate fi descrisă și cu ecuația lui Freund .
Materialele cu o suprafață rugoasă sau internă prezintă adesea un comportament de adsorbție diferit, care nu poate fi descris de izotermele Langmuir. Izoterma conform lui Brunauer, Emmett și Teller ( izoterma BET ) este adesea utilizată :
- , cu o constantă specifică sistemului.
Izotermele de adsorbție ale unor materiale precum gelul de siliciu prezintă o creștere abruptă la presiune scăzută (Fig. 8), dar au doar tendința de a converge și de a depăși devreme această valoare. Aici intră în joc condensarea capilară, care se apropie din punct de vedere energetic de căldura de adsorbție a unei ocupări monomoleculare.
Adsorbția concurentă
Dacă moleculele unui component ocupă suprafața unui adsorbant care a fost destinat separării unui alt component, aceasta se numește adsorbție concurentă. Acest lucru este important pentru sarcinile de separare tehnică, deoarece amestecurile de substanțe apar în multe cazuri (de exemplu, o hidrocarbură și vapori de apă). În astfel de cazuri, selectivitatea adsorbantului este de o mare importanță. Adsorbția concurentă poate fi observată și cuantificată prin măsurarea curbelor de progres cu două sau mai multe adsorbții.
Adsorbția chimică
| Adsorbția chimică | |||||||||||||||
| Monostrat | |||||||||||||||
| |||||||||||||||
|
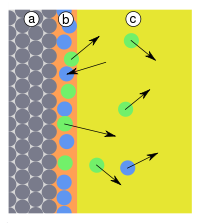
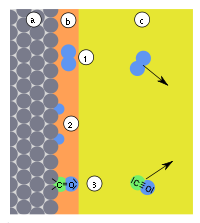
Fig. 9: a) adsorbant, b) adsorbat, c) faza gazoasă cu adsorptiv, (1) fizorbție, (2) chemisorbție disociativă (3) chemisorbție dirijată | |||||||||||||||
| Energie de adsorbție | |||||||||||||||
| |||||||||||||||
Adsorbție chimică ( chemisorption ) este o acumulare de substanțe pe suprafața solidelor , cum ar fi forțele de lipire chimice. În timp ce forțele de legare acționează până la aproximativ 40 kJ / mol în adsorbția fizică, căldurile de reacție în adsorbția chimică sunt cuprinse între 40 și 420 kJ / mol. În timpul chemisorbției, legăturile sunt făcute la suprafață și structura electronică din adsorbat este modificată. Datorită legăturilor directe la suprafață, se pot forma maximum straturi monomoleculare. În ciuda unei legături chimice la suprafață, adsorbatul se poate deplasa în cea mai mare parte de-a lungul suprafeței - la fel ca în fizizorbție.
Chemisorbția poate avea consecințe semnificative pentru substanța adsorbită, care depind de proprietățile adsorbatului, adsorbantului și de temperatura sistemului. Chemisorbția este un proces fundamental în cataliza catalizatorului solid, cunoscut sub numele de cataliză eterogenă . Legăturile din substanța adsorbită pot fi slăbite. Reacțiile chimice cu alți parteneri de reacție pot continua acum mai ușor; se vorbește despre o activare catalitică a reacției.
În anumite circumstanțe, legăturile din adsorbat pot fi rupte, ceea ce poate duce la descompunerea adsorbatului în două sau mai multe particule ( chimișorbție disociativă ). Deci z. B. Hidrogenul (H 2 ) pe metale precum fierul, platina și paladiul pentru a forma atomi de hidrogen legați individual (Fig. 9, (2)). Chimiisorptiile disociative pot duce la desorbirea particulelor, altele decât cele care au fost adsorbite. Chemisorbția a declanșat apoi o reacție chimică ( cataliză ).
Când este adsorbit pe metalele menționate mai sus, monoxidul de carbon (CO) se disociază doar la temperaturi ridicate. De regulă, are loc așa-numita chemisorbție direcționată : CO se leagă de suprafața metalică prin intermediul atomului de carbon (Fig. 9, (3)), analog direcției legăturii care apare cu carbonilii metalici .
Adsorbția este o reacție exotermă, care, totuși, poate avea loc prin stări de tranziție care sunt nefavorabil de mari în termeni de energie (adsorbție activată). În cazul adsorbției activate , spre deosebire de fizorbție, adsorbția are loc numai la temperaturi mai ridicate, iar viteza crește odată cu creșterea temperaturii.
Spre deosebire de fizizorbție, energia de activare a desorbției este deseori inegală cu energia de activare a adsorbției. Energia de activare a desorbției rezultă din modificările adsorbatului. In timp ce unele particule adsorbite ( de exemplu , H 2 sau O 2 ) sunt disociate, alte particule ( de exemplu CO 2 ) , s- au schimbat configurația lor spațială. Mărimea energiilor de activare și căldura de adsorbție depind nu numai de tipul de particule adsorbite sau de produsele lor de reacție, ci și de compoziția chimică și structura (electronică) a adsorptivului (tabelul „Energie de adsorbție”). În cazul chemisorbției, adsorbția poate fi ireversibilă dacă este necesară o energie de activare (prea) mare pentru desorbția anumitor particule. Dacă o astfel de chemisorbție are loc cu catalizatori, aceasta duce la dezactivare și este denumită otravă a catalizatorului .
Aplicații
Fizorbție
Deoarece căldura este eliberată în timpul adsorbției și căldura este absorbită în timpul desorbției, sunt construite pompe de căldură ( răcitoare de adsorbție ) bazate pe adsorbție . La acționarea răcitoarelor de adsorbție, starea fizică a fluidului este modificată.
Fizorbția în faza gazoasă
Ca adsorbanți , de exemplu, vin cărbune activ , cocs activat , silicagel sau site moleculare ( zeoliți ) sub formă de paturi sau într-o formă structurată pentru utilizare practică. Filtrele de gaz, cum ar fi filtrele de protecție respiratorie și procesele de uscare a aerului umed ( uscarea prin adsorbție ), se bazează pe fizorbție .
Procesele de adsorbție sunt adesea utilizate pentru curățarea gazelor de eșapament . Sunt folosite pentru a reține astfel de hidrocarburi. B. sub formă de solvenți sau vapori de benzină. Procesele de adsorbție sunt, de asemenea, utilizate pentru a elimina substanțele mirositoare, hidrogen sulfurat și dioxid de sulf. Adsorbția este, de asemenea, utilizată pentru a netezi vârfurile de concentrație în fața catalizatorilor de oxidare.
Multe procese de separare sau purificare, precum și analiza amestecurilor de substanțe se bazează pe metode cromatografice , cromatografia de adsorbție . Toate aceste metode utilizează reacția de echilibru specifică substanței de fizorbție între o interfață și o fază mobilă .
În cazul separării tehnice și a amestecurilor de gaze, se folosește fizorbția deoarece gazele se acumulează la diferite grade pe suprafața unui adsorbant, în funcție de presiune și temperatură. Se face distincția între schimbarea temperaturii modurilor de funcționare și adsorbția schimbării presiunii . De exemplu, hidrogenul de înaltă puritate poate fi obținut din gazul de sinteză . O altă aplicație pentru separarea tehnică a amestecurilor de gaze este îndepărtarea CO 2 din biogaz .
Fizorbția în faza lichidă
Pentru purificarea multor substanțe naturale și în zilele noastre în special în tratarea apelor , epurarea apelor uzate , remedierea apelor subterane și în gestionarea apelor industriale , adsorbția este utilizată pentru îndepărtarea substanțelor nocive din apă sau pentru recuperarea substanțelor.
Chemisorbție
Chemisorbția este procesul fundamental în cataliza eterogenă . Catalizatorii sunt solide adecvate pentru aceasta. Hidrogenul este utilizat pentru hidrogenarea legăturilor duble C = C și nichelul Raney sau aliajele de nichel-aluminiu sunt utilizate ca catalizator . Chemisorpția hidrogenului asupra catalizatorilor de asemenea , joacă un rol important în procesul Haber-Bosch pentru producerea NH 3 . Chemisorbția monoxidului de carbon și a hidrogenului permite sinteza hidrocarburilor în sinteza Fischer-Tropsch . De asemenea, catalizatori auto pe baza unei catalize eterogene.
literatură
- Wilhelm Schwieger, Helge Toufar: Materiale anorganice-poroase: preparare, prelucrare și producție industrială . Springer, Berlin 2007, ISBN 978-3-540-23649-8 .
- Dieter Bathen, Marc Breitbach: Tehnologia adsorbției . Springer, Berlin 2001, ISBN 978-3-540-41908-2 .
- LW Bruch, Milton W. Cole, Eugene Zaremba: Adsorbția fizică: forțe și fenomene . Dover Pubn Inc, 2007, ISBN 978-0-486-45767-3 .
- Stephen Brunauer: Adsorbția gazelor și vaporilor Vol I - Adsorbția fizică . Dodo Press, 2007, ISBN 978-1-4067-5030-0 .
- VDI 3674: 2013-04 Curățarea gazelor de ardere prin adsorbție; Curățarea gazelor de proces și a gazelor reziduale (Curățarea gazelor uzate prin adsorbție; Curățarea gazelor de proces și a gazelor uzate). Beuth Verlag, Berlin. ( Rezumat și cuprins online )
Dovezi individuale
- ↑ Peter W. Atkins, Julio de Paula: Chimie fizică. Ediția a IV-a. Wiley-VCH, Weinheim 2006, ISBN 978-3-527-31546-8 , p. 1026.
- ↑ R. Brdicka; În: Fundamentele chimiei fizice ; VEB Deutscher Verlag der Wissenschaften, Berlin 1958, p. 482.
- ↑ VDI 3674: 2013-04 Curățarea gazelor de eșapament prin adsorbție; Curățarea gazelor de proces și a gazelor reziduale, pp. 14-15.
- ^ Römpp Lexikon Chemie
- ↑ Heinz Kuschel: îndepărtarea adsorbtivă a unui amestec de solvent din aerul evacuat al unei companii de prelucrare a filmelor . Praful - curățenia. Luft , ISSN 0949-8036 , 36 (1976) nr. 7, pp. 303-306.
- ↑ VDI 3674: 2013-04 Curățarea gazelor de eșapament prin adsorbție; Curățarea gazelor de proces și a gazelor reziduale, pp. 51–62.
- ↑ Rolf Germerdonk: Adsorbția substanțelor mirositoare și a altor substanțe problematice . Praful - curățenia. Luft, ISSN 0949-8036 , 36 (1976) nr. 7, pp. 306-311.
- ↑ Kurt Hedden , L. Huber, BR Rao: Curățarea adsorbtivă a gazelor de eșapament care conțin hidrogen sulfurat . Praful - curățenia. Luft, ISSN 0949-8036 , 36 (1976) nr. 7, pp. 313-317.
- ↑ Karl Knoblauch, R. Noack: Experiență operațională cu procesul de cercetare minieră pentru desulfurarea gazelor arse . Praful - curățenia. Luft, ISSN 0949-8036 , 36 (1976) nr. 7, pp. 318-323.
- ↑ VDI 3476 foaia 2: curățarea gazelor de eșapament 2010-01 ; Metoda de purificare catalitică a gazelor de eșapament; Procese oxidative (curățarea gazelor reziduale; metode de curățare a gazelor reziduale catalitice; procese oxidative). Beuth Verlag, Berlin, p. 28.
- ↑ VDI 3896: 2015-10 Reducerea emisiilor; Pregătirea biogazului pentru calitatea gazelor naturale (Controlul emisiilor; Pregătirea biogazului pentru calitatea gazelor naturale). Beuth Verlag, Berlin, p. 15.
- ↑ Otto Westphal , Theodor Wieland , Heinrich Huebschmann: regulator de viață. Din hormoni, vitamine, fermenti și alte ingrediente active. Societäts-Verlag, Frankfurt pe Main 1941 (= Frankfurter Bücher. Cercetare și viață. Volumul 1), pp. 118–122.
- ↑ Gabi Förtsch, Heinz Meinholz: Manual de control operațional al poluării . 2013, Springer Spectrum, ISBN 978-3-658-00005-9 , pp. 286-293.

















![N = {\ frac {N _ {\ mathrm {m}} ap} {(p_ {0} -p) [1+ (a-1) p / p_ {0}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/acbcb4adddb1220b2d5eefcbc1a2ca3fa9045623)