Biofilm
Biofilmele constau dintr-un strat de mucus (un film) în care populațiile unice sau mixte de microorganisme (de exemplu , bacterii , alge , ciuperci , protozoare ) în concentrații de 10 12 celule pe mililitru de biofilm și de organisme multicelulare precum rotifere , nematode și acarieni , mici peri sau larve de insecte care se hrănesc cu microorganismele sunt încorporate. În viața de zi cu zi, ele sunt adesea percepute ca un strat de mucus sau un strat de mucus alunecos, cu senzație moale, care conține apă. Alți termeni colocviali sunt Aufwuchs , Kahmhaut sau Sielhaut .

Biofilmele se formează în principal în sisteme apoase atunci când microorganismele se așează acolo la interfețe . În principiu, toate zonele pot fi acoperite cu biofilme: între fazele gazoase și lichide (de exemplu, nivelul apei libere), fazele lichide și solide (de exemplu, pietrișul pe albia râului) sau între diferitele faze lichide (de exemplu, picăturile de ulei în apă). Interfața pe care se formează biofilmul, sau mai precis faza în care filmul nu crește sau greu crește, formează substratul ( substrat ; cel care se extinde mai jos).
Într-un sens mai larg, toate agregatele de microorganisme care sunt încorporate într-un strat de mucus format de acestea sunt denumite biofilme. Materia în suspensie din apă constă adesea din particule minerale acoperite de biofilme. Nămolului activat în stațiile de epurare a apelor uzate , de asemenea , are proprietăți esențiale ale unui biofilm. Se compune din fulgi care au ei înșiși o suprafață adecvată colonizării.
Biofilmele pot fi considerate o formă de viață foarte originală , deoarece cele mai vechi fosile care au fost găsite până acum provin din microorganisme din biofilme care au trăit acum 3,2 miliarde de ani. Acestea sunt stromatolite (roci sedimentare biogene) găsite în vestul Australiei ( Pilbara Kraton ). Biofilmul ca formă de viață s-a dovedit atât de bine încât este și astăzi răspândit. Marea majoritate a microorganismelor trăiesc în natură sub formă de biofilme.
compoziţie

Citoplasma (CP) a unei bacterii sferoplastate cu membrană citoplasmatică (CPM).
Intercelulară (IC) glycocalyx cu exo polizaharide (EPS), ADN (ADN) , hidrofob (HPR) și solubile în apă proteinele (SPR).
Membrana periplasmatică (PPM), peretele celular (W), periplasma (PPl), membrana citoplasmatică și citoplasma unei bacterii.
Pe lângă microorganisme, biofilmul conține în principal apă. Substanțele polimerice extracelulare (EPS) excretate de microorganisme formează hidrogeluri în combinație cu apă , creând o matrice slabă în care nutrienții și alte substanțe sunt dizolvate. Particulele anorganice sau bulele de gaz sunt, de asemenea, adesea închise de matrice. Faza gazoasă poate fi îmbogățită cu azot , dioxid de carbon , metan sau hidrogen sulfurat , în funcție de tipul de microorganisme .
EPS constă din biopolimeri care sunt capabili să formeze hidrogeluri și astfel conferă biofilmului o formă stabilă. Acestea sunt o gamă largă de polizaharide , proteine , lipide și acizi nucleici ( ADN extracelular ).
Diferite tipuri de microorganisme trăiesc în mod normal împreună în biofilme. În plus față de formatorii biofilm originali , pot fi integrate și alte organisme unicelulare ( amoebe , flagelate etc.). Zonele aerobe și anaerobe pot apărea la o distanță de câteva sute de micrometri , astfel încât microorganismele aerobe și anaerobe pot trăi aproape împreună.
formă
În zona centrală, biofilmul este de obicei compact (biofilm de bază). Zona de margine (biofilmul de suprafață) poate fi, de asemenea, compactă și în formă regulată și formează o interfață plană cu fluidul debordant, sau poate fi indistinctă și mult mai slabă. În acest din urmă caz, biofilmul de suprafață poate semăna cu o cale de munte și vale dacă, de exemplu, speciile bacteriene cresc sub formă de fire (filamentoase) în fluid sau dacă substratul este populat cu protozoare (de exemplu, clopote) sau specii de organisme superioare .
Matricea biofilmului este apoi adesea traversată de pori, caverne și pasaje care permit schimbul de substanțe între celulele bacteriene și o sursă de apă. Se găsesc deseori structuri în formă de ciupercă sau în formă de turn. Acolo, procesele de transport material convectiv apar atunci când lichidul curge prin ele. În zona suprafeței biofilmului, procesele de amestecare convectivă pot fi declanșate și prin mișcarea excrescențelor care ies în flux (de exemplu „ ciuperci de canalizare ”, cum ar fi Sphaerotilus natans ). În interiorul biofilmelor, substanțele dizolvate sunt transportate în principal prin difuzie . La stratul limită de apă, celulele sau părți întregi ale biofilmului pot fi eliberate în mod repetat și preluate de apa care curge în trecut.
Formarea și maturarea biofilmelor
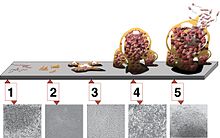
Formarea și formarea unui biofilm poate fi împărțit în trei faze: faza de inducție (Fig. 4 și 6, 1-2) faza de acumulare (3) și faza de existență (4-5).
Colonizarea suprafețelor
Conform credinței populare, microorganismele tipice au flageli (Fig. 6, 1) și se mișcă liber în coloana de apă. De fapt, astfel de celule de roire sunt de obicei numai în stadiul de răspândire a rezidenților biofilmului.
Faptul că majoritatea absolută a bacteriilor și archaea sunt înrădăcinate în biofilme are un motiv convingător: altfel ar fi spălate din biotopul lor de către apa vitală . Bacteriile solului vor ajunge în râul următor și de acolo își vor începe ultima călătorie în sedimentul unui ocean. Același lucru s-a întâmplat și cu microorganismele din nămolul activat al stațiilor de epurare .
Pentru a putea lăsa deloc apa liberă, microorganismele au nevoie de substanțe hidrofobe hidrofobe pe suprafața celulelor lor. Acestea permit organismelor să se atașeze de suprafețele hidrofobe pe baza forțelor Van der Waals . Deoarece aproape toate zonele din biotopurile acvatice sunt acoperite cu biofilme, majoritatea celulelor roioase se asociază cu biofilmele existente.
Astfel de organisme se pot atașa direct de zone nepopulate. Suprafețe hidrofobe netede, cum ar fi B. Polistirenul sau cuticula multor plante pot fi colonizate direct, dar numai dacă pot fi umezite cu apă . Cu toate acestea, datorită efectului de lotus , multe plante evită dezvoltarea frunzelor de microorganisme.
Un strat subțire și vâscos de substanțe organice este depus inițial pe suprafețe hidrofile goale . Acești biopolimeri provin din membranele mucoase care se formează în jurul celulelor bacteriene (EPS), se detașează ocazional complet sau parțial și se leagă adsorptiv atunci când intră în contact cu interfețele . Astfel de substanțe biogene sunt omniprezente în natură.
Metamorfoza pentru locuitorul biofilmului


1: Prima colonizare a unei zone de către o celulă flagelată. 2. Începutul formării biofilmului prin aderență celulară . 3. Creșterea exponențială . 4-5. Secțiuni parțiale ale suprafeței biofilmului. 4. Deficiență de nutrienți în centru. Faza a 5-a a migrației prin sporulare și celule flagelate.
Dacă locul de atașare permite organismului respectiv să crească, de obicei își varsă flagelul (ii). Cu toate acestea, în multe organisme se produce o schimbare mult mai profundă.
Acest lucru este clar vizibil în Caulobacter , un α-Proteobacterium aerob . După pierderea flagelului, celula de roire își retrage pilii, care sunt folosiți pentru atașare, și devine o celulă de tulpină. Spre deosebire de celula roiului, este capabilă să se divizeze și începe imediat cu o diviziune asimetrică. Se creează o nouă celulă de roire. După separare, celula stem poate forma în mod repetat noi celule de roire în condiții adecvate.
Modificările bacteriei solului Bacillus subtilis sunt cel puțin la fel de profunde (Fig. 6). După ce flagelul a fost atașat și pierdut, structurile filamentoase se dezvoltă în timpul diviziunilor celulare ulterioare, deoarece pereții celulari ai organismelor nu sunt separați. În același timp, polimerii sunt excretați, ceea ce conferă rezistenței laterale a filmului rezultat. Astfel de modificări sunt declanșate epigenetic .
Ca urmare a multiplicării celulelor care s-au atașat la o suprafață, organismele se răspândesc. Interfața este populată mai întâi pe o zonă mare sub forma unui film (biofilm). În același timp sau mai târziu, biofilmele cresc în mai multe straturi și formează în cele din urmă structuri tridimensionale eterogene. Până în această fază, Bacillus subtilis produce aproape exclusiv agregate celulare filamentoase.
Evitarea concurenței
În principiu, există concurență între celulele unui biofilm pentru nutrienți în care acele celule care sunt cele mai apropiate de sursa de hrană au un avantaj clar. În schimb, celulele din interior amenință să moară de foame. Dacă se întâmplă acest lucru, atunci nu mai sunt capabili să mențină coeziunea. De fapt, există mecanisme de reglare a densității celulare și de comunicare între celule ( detectarea cvorumului ) care contracarează acest lucru.
Un astfel de mecanism a fost elucidat pentru prima dată în detaliu pentru Bacillus subtilis în 2015. În acest scop, un biofilm dintr-o cultură pură a acestor bacterii a fost examinat într-un bioreactor chemostat . Biofilmul a fost alimentat continuu cu substanțe nutritive și, totuși, celulele și-au întrerupt periodic creșterea până când celulele din interiorul biofilmului au încetat să moară de foame. Această "oscilație" se bazează pe următoarea secvență:
- Infometati celule din interiorul biofilmului trimite un puls de K + - ionii de. Celulele biofilmului B. subtilis au receptori pentru acești ioni care declanșează un întreg lanț de evenimente.
- Toate celulele, inclusiv celulele bine furnizate, trimit ele însele un semnal K + imediat după primire . Există canale K + specifice în biofilm pentru propagarea semnalelor . (Difuzia normală prin matricea polimerică a biofilmului ar fi prea lentă.)
- Celulele care sunt încă bine furnizate își întrerup imediat creșterea, dar nu activitatea lor metabolică. Dacă există o lipsă de azot, aceștia iau z. B. glutamina din mediul nutritiv, dar nu utilizați acest aminoacid pentru creștere, ci separați amoniul din acesta, pe care îl pun la dispoziția biofilmului.
- Dacă semnalele scad, creșterea va continua împreună.
Comunicarea dintre celulele bacteriene pe baza K + nu este singura. Există o serie de feromoni pe care organismele îi pot produce și percepe. Aceasta inițiază, de asemenea, următoarea fază a existenței unui biofilm (vezi Fig. 6.5). Din nou, există o metamorfoză a celulelor. În celulele de roi bine aprovizionate, se formează celule de roi flagelate, a căror direcție de înot preferată este la sursa de nutrienți. Multe bacterii, cum ar fi B. subtilis, formează , de asemenea, spori în această fază . Acestea sunt purtate de curent și sunt pregătite pentru deficiențe de nutrienți pe termen lung.
Această fază a emigrației nu este în niciun caz sfârșitul unui biofilm. Pentru eliberarea sporilor și a celulelor de roire, matricea extracelulară este dizolvată numai în mod activ în împrejurimile lor . În partea veche a biofilmului, viața continuă cu o nouă fază de creștere.
Faptul că adâncimea biofilmului este limitată poate fi văzut când părți întregi ale biofilmului sunt transportate de curent. Coeziunea părților din biofilm se pierde prin formarea de bule de gaz (de exemplu, prin denitrificare și dioxid de carbon). Creșterea rezistenței la curgere cu creșterea grosimii duce la creșterea eroziunii dacă biofilmul s-a format pe suprafețe pe care curge curgerea . Viața în astfel de fragmente de biofilm nu este fundamental diferită de biofilmele care sunt atașate undeva. Astfel de fulgi au toate proprietățile de atașare la o suprafață nouă.
Viața în biofilm - protecție și comunitate
Procesele de viață ale bacteriilor din biofilm diferă semnificativ de cele din starea planctonică , adică în suspensie liberă . Celulele mobile de roire produc EPS diferite decât în starea biofilmului.
Matricea oferă stabilitate mecanică și permite organismelor biofilm să construiască interacțiuni sinergice pe termen lung , să supraviețuiască perioadelor de foame și împiedică spălarea enzimelor extracelulare .
Unele gene sunt pornite, iar altele oprite prin contactul cu suprafața. Folosind molecule speciale de semnalizare , acestea pot comunica între ele și pot activa și dezactiva reciproc alte gene. Ei își extind repertoriul genetic prin transfer orizontal de gene prin schimbul de gene cu celule vecine.
Acest lucru a dus la o formă de viață flexibilă, eficientă și universală, care este cu siguranță comparată cu organismele multicelulare.
Biofilmul oferă microorganismelor individuale o protecție excelentă și le permite să se adapteze la condițiile de mediu în schimbare: Acest lucru crește toleranța la fluctuații extreme de pH și temperatură, poluanți (de exemplu bactericide ), dar și raze UV și X, precum și lipsa hranei .
Cauzele posibile ale acestei inhibiții a influențelor nocive asupra mediului sunt:
- penetrare dificilă - poluanții nu pot pătrunde în biofilme
- condiții nefavorabile pentru substanța activă din biofilm
- diversitate mare de bacterii din biofilm
- Comportamentul diferit al celulelor sau grupurilor bacteriene individuale în diferite puncte ale biofilmului (cu alte cuvinte „mai aproape” sau „mai departe” de nutrienți, oxigen ( zone aerobe și anaerobe ), antibiotice sau reacții ale sistemului imunitar) - chiar și cu moarte bacteriană la scară, cele izolate supraviețuiesc deseori așa-numitelor „persistente”, care, datorită nutrienților prezenți, au condiții aproape ideale pentru reproducere reînnoită.
- rate de creștere mai lente ale bacteriilor din biofilm - bacteriile prezintă uneori un metabolism redus până la stadiile latente (VBNC - „viabil, dar neculturabil”) și, prin urmare, nu absorb aproape niciun otrăv cu antibiotice, ele în esență se protejează prin inactivitate.
Apariție
Apariție naturală
Biofilmele apar peste tot - în toate solurile și sedimentele, pe roci, pe și în plante și animale, în special pe membranele mucoase; în gheața ghețarilor , în izvoarele fierbinți , pe rocile din deșert , în acid sulfuric diluat și sodă caustică diluată , în țevi și tuburi, în combustibilul pentru jet și în rezervoarele de petrol, în nave spațiale și submarine, chiar și în zone foarte contaminate radioactiv de centrale nucleare. Formează covorase microbiene în zonele umede.
Biofilmele au o mare importanță ecologică. Acestea sunt implicate în ciclurile globale de carbon, oxigen, azot, sulf, fosfor și multe alte elemente. Mobilizează substanțe din minerale. Se leagă mult dioxid de carbon , contracarând astfel efectul de seră .
Organismele din biofilme sunt capabile să descompună substanțele care sunt greu de descompus prin interacțiunea lor. Acestea joacă un rol central în procesele de autocurățare a habitatelor naturale. Așa că joacă un rol major în autocurățarea apei.
La interfețele sau cavitățile corpului animalelor există populații de biofilme „locale”, adesea nepatogene ( nepatogene ). Exemple în acest sens sunt comunitățile bacteriene ale pielii, gurii și intestinelor ( piele , gură și flora intestinală ). Placa, placa care se formează pe dinți este un biofilm.Bacteriile implicate merg împreună cu gazda cu o corelație interspecifică . Sunt considerați comensalii imediat ce beneficiază de gazdă. Dacă ambele tipuri beneficiază, este mutualismul . În această formă de interacțiune, bacteriile îndeplinesc o serie de sarcini. Acestea sunt importante în maturarea sistemului imunitar în primii câțiva ani de viață. În plus, bacteriile potențial patogene sunt ținute departe sau procesele digestive sunt susținute. Dacă există un dezechilibru în populație, acest lucru poate duce la boli.
Boli infecțioase
Deși biofilmele sunt omniprezente în natură, importanța lor clinică în medicină este adesea subestimată. Acest lucru se aplică în special infecțiilor, deoarece în mai mult de 60% din toate bolile infecțioase bacteriene, agenții patogeni se protejează de sistemul imunitar prin formarea de biofilme . Deoarece o mare parte a instrumentației microbiologice inițiale a fost dezvoltată în cursul epidemiilor majore , acest lucru a fost făcut cu accent pe bacteriile plutitoare libere (planctonice), care se divid rapid în infecțiile acute (vezi postulatele Henle-Koch ). Cu toate acestea, izolarea și cultura pură din laborator necesare aici conduc la pierderea considerabilă a genelor din bacterii în condiții convenționale de laborator și, în cele din urmă, la pierderea capacității de a forma biofilme. Din această cauză și din cauza fazelor de odihnă menționate mai sus , biofilmele din faza de acumulare se sustrag deseori de la examinarea detaliată pe lângă detectarea prin metode convenționale de cultură a microorganismelor . Tehnicile moderne de vizualizare, cum ar fi microscopia confocală și sondele genetice pentru localizarea și identificarea organismelor biofilmului folosind microscopia fluorescentă au contribuit la o mai bună înțelegere a biofilmelor.
În cursul maturizării biofilmului, în faza existenței, coordonată de detectarea cvorumului , se acumulează acumulări bacteriene mai mari. Acest lucru creează o sursă de germeni care duc la infecții cronice și recurente la pacienți ( bacteremie ) și, în anumite circumstanțe, chiar la sepsisul adesea fatal . Acest lucru este valabil mai ales pentru pacienții cu un sistem imunitar slăbit. Biofilmele au fost legate de o serie de infecții. Exemple pentru aceasta sunt:
- borrelioză cronică Lyme , cu sau fără afectare nervoasă ( neuroborrelioză sau neuroborrelioză Lyme )
- Osteomielita
- Infecții ale plăgilor
- endocardită bacteriană
- Boala parodontală
- Uretrită
- Prostatita
- Carii dentare
- Peri-implantită
- otita medie cronică la copii
- Vaginoza bacteriană
Infecțiile asociate corpului străin sunt o altă zonă afectată. Aceasta include contaminarea microbiană și colonizarea cateterelor , implanturilor și instrumentelor medicale. Utilizarea tot mai mare a materialelor plastice în tehnologia medicală , pe lângă marile avantaje inerente pentru diagnosticare și terapie, a agravat problema biofilmului. Datorită afinității diferitelor microorganisme, cum ar fi unele stafilococi , la suprafețele biomaterialelor , aproximativ jumătate din infecțiile nosocomiale pot fi urmărite înapoi la implanturile chirurgicale. Punctul de plecare pentru microorganismele implicate sunt suprafața pielii personalului spitalului și a pacienților, contactul punctelor de ieșire sau a conectorilor cu apa de la robinet și alte surse din mediu. Conductele de apă ale spitalelor și ale unităților de tratament dentar, precum și echipamentele de dializă și endoscoapele greu de curățat pot fi, de asemenea, afectate. În funcție de dispozitivul medical utilizat și de durata de ședere, bacteriile și ciupercile gram-pozitive, gram-negative apar ca biofilme unice sau multi-specii. Exemple de agenți patogeni care sunt adesea implicați sunt:
- Borrelia burgdorferi , alte tipuri de Borrelia patogene pentru oameni ( B. garinii, B. afzelii, B. valaisiana, B. lusitaniae și B. spielmanii )
- Stafilococ epidermid
- Staphylococcus aureus
- Pseudomonas aeruginosa
- Escherichia coli
- Candida albicans
Datorită rezistenței crescute parțial inexplicabile, generale și antibiotice, a bacteriilor din biofilm (inclusiv prin transfer crescut de gene orizontale, formarea de „persistente” și diversitate mare - vezi mai sus ), îndepărtarea respectivului implant este necesară în multe cazuri . Sistemele cu suprafețe mari și puncte de penetrare a pielii sunt deosebit de expuse riscului. Exemple de dispozitive medicale afectate frecvent de infecții asociate corpului străin sunt:
- Cateter venos
- valvele cardiace artificiale
- Proteze articulare
- Cateter de dializă peritoneală
- Pacemaker
- Tuburi endotraheale
- Proteze vocale
- Shunturile lichidului cefalorahidian
- Implanturi dentare
Potrivit lui JW Costerton (a se vedea literatura ), se așteaptă ca utilizarea proceselor și abordărilor din ecologia microbiană să conducă la sinergii considerabile și, astfel, la un avans semnificativ în înțelegerea și terapia biofilmelor relevante din punct de vedere medical pentru microbiologia medicală .
Rani
Biofilmele pot fi detectate pe 60-90% din rănile cronice . Acestea joacă un rol cheie în dezvoltarea leziunilor normale ale țesuturilor într-o rană cronică. Un biofilm care acoperă baza plăgii perturbă procesul de vindecare și pune, de asemenea, în pericol persoanele afectate, a căror stare imunitară este restricționată de rana cronică sau de boala de bază. Prin urmare, îndepărtarea biofilmului este o parte fundamentală a îngrijirii rănilor. Pentru îndepărtarea măsurilor Biofims sunt utilizate de debridare , de exemplu, larve terapeutice sau curățarea plăgii cu ultrasunete . Tratamentul antiseptic local ulterior al plăgii împiedică reconstrucția biofilmului pe patul plăgii.
Alimente
Pentru a preveni contaminarea apei și a alimentelor , dar și a medicamentelor și produselor cosmetice de către microorganisme, sunt necesare măsuri constante împotriva formării biofilmelor. În fiecare an, se produc cantități mari de apă contaminate de agenți de curățare și dezinfectanți .
Biocorozie
În prezența biofilmelor, se observă biocorozia. Aici, oxidanții de fier conținuți în stratul de suprafață iubitor de oxigen (aerob) duc la un atac asupra stratului pasiv (al metalelor) - reductorii de sulfat din stratul anaerob se atașează la aceste puncte și se „intră” în material.
Coroziunea microbiologică produce daune economice considerabile în fiecare an. Proporția coroziunii totale (adică coroziunea abiotică și biotică) este estimată a fi de cel puțin 20%; conform unor descoperiri mai recente, este probabil semnificativ mai mare. Chiar și materialele din aliaje superioare precum V2A și V4A sunt deteriorate. Aproape toate sistemele tehnice sunt afectate de acest lucru: Circuite de răcire, sisteme de tratare a apei și servicii de apă, generarea de energie în centrale electrice, producția de mașini, computere, vopsele, industria petrolului și gazelor. În vechile situri miniere, levigarea biologică a mineralelor de către biofilme duce la deteriorări extinse ale mediului în sol, apă și aer datorate poluării cu praf și emisiilor de acid sulfuric, metale grele, radon și radionuclizi.
Biofouling
În cazul tratamentului apei care utilizează procese cu membrană, biofilmele sunt responsabile pentru biofouling , ceea ce cu această tehnologie duce la perturbări grave.
Biofoulingul include, de asemenea, biofilme care se formează pe corpurile subacvatice. Acest lucru poate duce la probleme semnificative. Un biofilm de doar o zecime de milimetru reduce viteza unui cisternă cu 10 până la 15% din cauza rezistenței crescute la frecare . Acest lucru are ca rezultat creșterea consumului de combustibil. În lupta împotriva creșterii organice (inclusiv balanele și midiile), substanțe speciale sunt vopsite pe nave, platforme și geamanduri, ale căror ingrediente active sunt eliberate în apă și prezintă adesea un impact semnificativ asupra mediului. O astfel de substanță este tributiltinul (TBT) extrem de toxic, care a fost interzis acum la nivel mondial . Sunt afectate și sistemele de senzori în scopuri de cercetare sau monitorizare în sectorul maritim, unde vegetația poate duce foarte repede la afectări funcționale.
Gradienții de concentrație ai parametrilor fizico-chimici din biofilme pot fi determinați utilizând microsenzori de înaltă rezoluție (= examinare funcțională) și corelați cu datele biologice moleculare din distribuția în profunzime a populațiilor microbiene prezente în biofilm (= examinare structurală). Scopul ideal este de a combina structura și funcția populațiilor microbiene din biofilm cu date (deteriorare / coroziune) din zona de creștere. Acest lucru contribuie la o mai bună înțelegere a interacțiunii dintre biofilmul care provoacă daune și zona de creștere, care prezintă un interes deosebit în sistemele aplicate (de exemplu, biofilmele marine din țevile de oțel).
Biofilme în sisteme de răcire prin evaporare
În sistemele de răcire prin evaporare, biofilmele pot afecta sănătatea angajaților. Pseudomonas aeruginosa este unul dintre primii colonizatori ai biofilmelor și poate provoca boli inflamatorii. În special în timpul lucrărilor de curățare și întreținere, poate exista contact direct cu pielea și căile respiratorii.
utilizare
Biotehnologia face deja interfețele utilizabile în multe feluri. Aceasta variază de la utilizarea imobilizat, i. H. enzime și microorganisme legate la suprafață prin tratarea apelor uzate cu reactoare biofilm și tratarea deșeurilor biologice la leșierea microbiană a minereurilor.
Producția de oțet
Unul dintre cele mai cunoscute exemple de utilizare industrială a biofilmelor este probabil producția de oțet cu ajutorul bacteriilor de oțet , care, fie ca o spumă pe un lichid care conține alcool (proces Orléans), fie așezat pe așchii de lemn (proces generator) , formează un biofilm care transformă etanolul în acid acetic.
Utilizare în tehnologia apelor uzate
Utilizarea microorganismelor imobilizate pentru tratarea apelor uzate sub formă de biofilme a început încă din secolul al XIX-lea. Procesele de biofilm sunt foarte potrivite pentru tratarea apelor uzate. Microorganismele sunt legate de o suprafață solidă și, prin urmare, nu sunt evacuate din stația de epurare cu apele uzate.
Substanțele care poluează apa sunt o sursă de energie și hrană pentru microorganisme. Cu structura lor ramificată, biofilmele au o suprafață de adsorbție foarte mare. Drept urmare, substanțele care nu pot fi prelucrate imediat pot fi atașate la o anumită măsură de biofilm și ulterior defalcate în perioadele cu consum redus de alimente.
În funcție de tipul de reactor, se face distincția între filtrele de scurgere , discurile submersibile , paturile fixe aerobe și anaerobe și paturile plutitoare .
Eliminarea deșeurilor biologice
Biofilmele fac posibilă eliminarea deșeurilor biologice prin colonizarea și descompunerea deșeurilor.
Curățarea biologică a gazelor de eșapament
Cu curățarea gazelor de eșapament prin intermediul unui reactor cu pat bioresel , un biofilm este utilizat pentru a descompune poluanții atmosferici care au trecut în faza apoasă.
Remediere sol
Chiar și poluanții solului, cum ar fi uleiul vărsat, pot fi defalcați de microorganismele relevante.
Prevenirea / controlul biofilmelor
Mai multe institute independente confirmă faptul că în eliminarea durabilă a biofilmelor în sistemele tehnice, dezinfectarea apei cu catalizatori metalici complet în legătură cu utilizarea redusă a peroxidului de hidrogen a avut succes în utilizarea tehnică de mai bine de zece ani (prima utilizare tehnică 1997). Utilizarea biochimică a germenilor formează biosurfactanți pe catalizator , care elimină biofilmul specific speciei.
Pe de altă parte, alte institute afirmă că singura utilizare a peroxidului de hidrogen nu are nici o eficiență în ceea ce privește dezinfectarea. O H 2 O 2 concentrație de 150 mg / l , cu un timp de contact de 24 ore a arătat nici o ucidere , nici un efect de detașare când dezinfectarea sistemelor de apă potabilă, nici chiar prin adăugarea de ioni de argint (150 pg / l). Deoarece tratamentele cu biocide nu au îndepărtat biofilmele, ci mai degrabă biomasa moartă a rămas pe suprafețe, o selecție de organisme individuale rezistente („persistente”) și introducerea de noi organisme în sistemul de testare duc rapid la re-germinare.
Dioxidul de clor dezinfectant prezintă o degradare bună a biofilmului. Molecula este neutră din punct de vedere electric și poate pătrunde în stratul EPS al biofilmelor și în membranele celulare ale microorganismelor. Spre deosebire de aceasta, clorul elementar, care se disproporționează cu acid clorhidric și acid hipocloros în apă, se dovedește a fi semnificativ mai puțin eficient deoarece, în funcție de valoarea pH-ului, este parțial prezent ca ion hipoclorit și acest lucru - datorită încărcării sale negative - o penetrare a biofilmului și a membranei celulare nu mai este garantată în mod fiabil.
În plus, procesul de catalizare indusă de lumină pentru tratarea apei a existat de câțiva ani . Pe baza proceselor naturale din natură, sistemele purtătoare de apă sunt menținute într-o stare fără biofilm în prezența unui catalizator adecvat sub influența luminii de zi.
Există, de asemenea, diverse metode, în principal experimentale, de prevenire sau combatere a biofilmelor. Prevenirea este adesea utilizată pentru a preveni formarea de biofilme în primul rând. Exemple de abordări diferite sunt:
- Minimizați intrarea de nutrienți organici pentru a priva microorganismele de existența lor
- Măsuri de dezinfectare și sterilizare a apei, de ex. B. Clorurarea
- distrugerea mecanică a biofilmelor
- În biotehnologie, biofilmele trebuie prevenite în conductele care transportă apă pură și ultrapură. De regulă, ozonul este alimentat în acest scop .
- Bacteriofag
- peptide antimicrobiene (AMP)
- Perturbarea comunicării ( detectarea cvorumului ) a bacteriilor din biofilm pentru a preveni așezarea sau detașarea
- cu enzime
- cu așa-numitele furanone ( se folosește ca model alga roșie australiană Delisea pulchra )
- Modificarea suprafeței (acoperiri anti-bacteriene)
- Hidrofilizare
- Nanostructurare (vezi efectul de lotus )
- sarcină negativă
- Tratamentul cu plasmă, de ex. B. aplicarea carbonului de tip diamant ( carbon de tip diamant (DLC))
- Evitarea suprafețelor aspre
- acoperire cu antibiotice , de ex. B. Minociclina - rifampicina
- acoperire antiseptică , de ex. B. Clorhexidina - sulfadiazina de argint
- Introducerea metalelor, de ex. B. argint, platină, bismut
- Acoperire bacteriană, de ex. B. Escherichia coli nepatogenă (nepatogenă) pe cateter urinar
- suprafețe dinamice (adesea cu o abordare bionică )
- curent electric
- „Skinling” sau „Peeling”
- „Creșterea” structurilor
- „Formarea nămolului”
- Vibrația suprafeței
literatură
- Hans-Curt Flemming: Biofilms - Life on the Edge of the Faza de apă . În: Știri din chimie . 4 (2000), pp. 442-447.
- Hans-Curt Flemming, Jost Wingender: Biofilmele - forma de viață preferată pentru bacterii: fulgi, filme și nămol . În: Biologia în timpul nostru . 31 (3) (2001), ISSN 0045-205X , pp. 169-180.
- John William "Bill" Costerton: The Biofilm Primer (Springer Series on Biofilms) . Springer-Verlag, Berlin / Heidelberg / New York 2007, ISBN 978-3-540-68021-5 , doi: 10.1007 / b136878 .
- R. Walter, K. Büsching, H. Lausch: Dezinfectarea apei cu catalizatori metalici plini și peroxid de hidrogen. În: apă, sol, aer. 1-2 / 2005, p. 30.
- Flemming, H.-C., Wingender, J. (2010): Matricea Biofilm. Nat. Pr. Microbiol. 8 623-633
- A. Houry, M. Gohar și colab.: Înotători bacterieni care se infiltrează și preiau matricea biofilmului. În: Proceedings of the National Academy of Sciences din Statele Unite ale Americii . [Publicație electronică înainte de a merge la presă] iulie 2012. doi: 10.1073 / pnas.1200791109 , PMID 22773813 .
- Garth D. Ehrlich, Patrick J. DeMeo, J. William Costerton, Heinz Winkler (Eds.): Culture Negative Orthopedic Biofilm Infections , Seria: Springer Series on Biofilms, Vol. 7, 2012, ISBN 978-3-642-29553- 9 (tipărit) 978-3-642-29554-6 (online)
- Flemming, H.-C., Wingender, J., Kjelleberg, S., Steinberg, P., Rice, S., Szewzyk, U. (2016): Biofilms: a emergent form of microbial life. Nat. Pr. Microbiol. 14, 563-575
Link-uri web
- Centrul Biofilm (Universitatea din Duisburg-Essen): De ce cercetarea biofilmului?
- Stern.de - Știință și sănătate, 27 noiembrie 2006: Biofilme: Bacteria-WG în stimulator cardiac
- Michael Lange și Martin Winkelheide : Un univers făcut din nămol - Cum trăiesc bacteriile în biofilme , Deutschlandfunk - Știință în centrul atenției din 11 iunie 2006:
- Institutul pentru Ingineria Proceselor de Mediu de la Universitatea din Bremen - Abwasserlexikon: Biofilm
- Comunicat de presă: Grupul de cercetare DFG „Chimia fizică a biofilmelor”
- Society of German Chemists (GDCh): Biofilme în apă - utile sau dăunătoare? ( Memento din 5 martie 2008 în Arhiva Internet )
- Center for Biofilm Engineering: Ce este biofilmul? ( Memento din 3 mai 2010 pe Arhiva Internet ), Universitatea de Stat din Montana
- Biofilms: The Hypertextbook , versiunea 4 ianuarie 2010, Universitatea de Stat din Montana
Dovezi individuale
- ↑ a b c Karl Höll: Apa. ISBN 978-3-110-22677-5 , p. 669 ( previzualizare limitată în căutarea de carte Google).
- ↑ Michel Vert, Yoshiharu Doi, Karl-Heinz Hellwich, Michael Hess, Philip Hodge, Przemyslaw Kubisa, Marguerite Rinaudo, François Schué: Terminologie pentru polimeri și aplicații biorelate (Recomandări IUPAC 2012) . În: Chimie pură și aplicată . 84, nr. 2, 2012, pp. 377-410. doi : 10.1351 / PAC-REC-10-12-04 .
- ↑ Andreas Schmidt-Wilckerling: Activitatea metabolică a celulelor libere suspendate și imobilizate de bacterii oxidante de amoniac. Teza de diplomă, Hamburg (1989).
- ^ A b c Luanne Hall-Stoodley, J. William Costerton și colab.: Biofilme bacteriene: de la mediul natural la boli infecțioase . În: Nature Review Microbiology . Vol. 2, nr. 2, 2004, ISSN 1740-1526 , PMID 15040259 , doi: 10.1038 / nrmicro821 , pp. 95-108 (fișier PDF; 0,6 MB) .
- ↑ Hera Vlamakis, Yunrong Chai, Pascale Beauregard, Richard Losick, Roberto Kolter: Rămânând împreună: construind un biofilm în sensul Bacillus subtilis . În: Nat Rev Micro . 11, nr. 3, 2013, pp. 157-168. doi : 10.1038 / nrmicro2960 .
- ↑ Yunrong Chai, Thomas Norman, Roberto Kolter, Richard Losick: Un comutator epigenetic care guvernează separarea celulelor fiice în Bacillus subtilis . În: Gene și dezvoltare . 24, nr. 8, 2010, pp. 754-765. doi : 10.1101 / gad.1915010 .
- ↑ Jintao Liu, Arthur Prindle, Jacqueline Humphries, Marcal Gabalda-Sagarra, Munehiro Asally, Dong-yeon D. Lee, San Ly, Jordi Garcia-Ojalvo, Gurol M. Suel: Co-dependența metabolică dă naștere la oscilații colective în cadrul biofilmelor . În: Natura . 523, nr. 7562, 2015, pp. 550-554. doi : 10.1038 / nature14660 .
- ↑ Arthur Prindle, Jintao Liu, Munehiro Asally, San Ly, Jordi Garcia-Ojalvo, Gurol M. Suel: Canalele ionice permit comunicarea electrică în comunitățile bacteriene . În: Natura . 527, nr. 7576, 2015, pp. 59-63. doi : 10.1038 / nature15709 .
- ↑ James A Shapiro: Gândindu-ne la populațiile bacteriene ca la organisme multicelulare . În: Revizuiri anuale în microbiologie . 51, nr. 1, 1998, pp. 81-104. doi : 10.1146 / annurev.micro.52.1.81 .
- ^ Carl R. Woese, Nicholas Chia, Nigel Goldenfeld: Un mecanism colectiv pentru variația fazelor în biofilme . În: Proceedings of the National Academy of Sciences . 105, nr. 38, 2008, pp. 14597-14602. doi : 10.1073 / pnas.0804962105 .
- ↑ Kim Lewis: Ghicitoarea rezistenței la biofilme . În: Agenți antimicrobieni și chimioterapie . Vol. 45, nr. 4, 2001, ISSN 0066-4804 , PMID 11257008 , doi: 10.1128 / AAC.45.4.999-1007.2001 , pp. 999-1007 (fișier PDF; 0,2 MB) .
- ↑ Ulrich Szewzyk, Regine Szewzyk: Biofilme - modul de viață ușor diferit . În: BIOspectru . Vol. 9, 2003, ISSN 0947-0867 , pp. 253-255. (Fișier PDF; 0,3 MB).
- ↑ C. Mark Ott, Rebekah J. Bruce și colab.: Caracterizarea microbiană a condensului plutitor liber la bordul stației spațiale Mir . În: Ecologie microbiană . Vol. 47, nr. 2, 2004, ISSN 1432-184X , PMID 14569419 , doi: 10.1007 / s00248-003-1038-3 , pp. 133-136, fișier PDF; 0,9 MB. ( Memento din 15 mai 2009 în Arhiva Internet )
- ↑ Joe J. Harrison, Raymond J. Turner și colab.: Biofilms - O nouă înțelegere a acestor comunități microbiene conduce o revoluție care poate transforma știința microbiologiei . În: om de știință american . Vol. 93, nr. 6, 2005, ISSN 0003-0996 , doi: 10.1511 / 2005.6.508 , pp. 508-515. (versiune online) ( Memento din 17 noiembrie 2007 în Arhiva Internet ).
- ↑ Christoph A. Fux, J. William Costerton și colab.: Strategii de supraviețuire a biofilmelor infecțioase . În: Tendințe în microbiologie . Vol. 13, nr. 1, 2005, ISSN 0966-842X , PMID 15639630 , doi: 10.1016 / j.tim.2004.11.010 , pp. 34-40.
- ↑ Yogita N. Sardessai: bacterii viabile, dar neculturabile: impactul lor asupra sănătății publice . În: Știința actuală . Vol. 89, nr. 10, 2005, ISSN 0011-3891 , p. 1650. (fișier PDF; 0,01 MB) .
- ↑ Eliana Drenkard, Frederick M. Ausubel: Formarea biofilmului Pseudomonas și rezistența la antibiotice sunt legate de variația fenotipică . În: Natura . Vol. 416, nr. 6882, 2002, ISSN 1476-4687 , PMID 11961556 , doi: 10.1038 / 416740a , pp. 740-743 (fișier PDF; 0,3 MB)
- ↑ J. William Costerton, Philip S. Stewart și colab.: Biofilme bacteriene: o cauză comună a infecțiilor persistente . În: Știință . Vol. 284, nr. 5418, 1999, ISSN 0036-8075 , PMID 10334980 , pp. 1318-1322.
- ↑ Luanne Hall-Stoodley, Fen Ze Hu și colab.: Detectarea directă a biofilmelor bacteriene pe mucoasa urechii medii a copiilor cu otită medie cronică . În: Jurnalul Asociației Medicale Americane . Vol. 296, nr. 2, 2006, ISSN 0098-7484 , PMID 16835426 , doi: 10.1001 / jama.296.2.202 , pp. 202-211.
- ↑ Joseph M. Patti: Vaccinuri și imunoterapie pentru infecții stafilococice . În: Jurnalul internațional al organelor artificiale . Vol. 28, nr. 11, 2005, ISSN 0391-3988 , PMID 16353122 , pp. 1157-1162.
- ↑ Rodney M. Donlan: Biofilme și infecții asociate dispozitivelor . În: Boli infecțioase emergente . Vol. 7, nr. 2, 2001, ISSN 1080-6040 , PMID 11294723 , pp. 277-281. (Fișier PDF; 0,1 MB) .
- ↑ Henk J. Busscher, Gésinda I. Geertsema-Doornbusch și colab.: Adeziunea la cauciuc siliconic a drojdiilor și bacteriilor izolate din proteze vocale: influența filmelor de condiționare salivară . În: Jurnal de cercetare a materialelor biomedicale . Vol. 34, nr. 2, 1997, ISSN 0021-9304 , PMID 9029300 , doi : 10.1002 / (SICI) 1097-4636 (199702) 34: 2% 3C201 :: AID-JBM9% 3E3.0.CO; 2- U , pp. 201-209.
- ↑ Klaus Müller: Lăsați totul în seama pacientului? . În: Magazin dentar 5/2007, pp. 36-39 ISSN 0176-7291 , http://www.zahnheilkunde.de/beitragpdf/pdf_5318.pdf .
- ↑ D. Keast, T. Swanson, E. Carville, I. Fletcher, G. Schultz, J. Black: Ten Top Tips. Înțelegerea și gestionarea biofilmului plăgii în Wounds International Journal 2014, 5 (2), paginile 20-24
- ↑ a b Christine Murphy, Lianne Atkin, Terry Swanson și colab: sfidarea rănilor greu de vindecat cu o strategie de intervenție timpurie a antibiofilmului: igiena rănilor. Un document de consens internațional , Journal of Wound Care, Vol 29, martie 2020 Text online la biblioteca online MAG accesat pe 19 iulie 2020
- ↑ Kerstin Protz: cunoștințe practice, standarde și documentație moderne pentru îngrijirea rănilor , Elsevier Verlag Urban & Fischer, München 2016, ISBN 978-3-437-27885-3 , paginile 27-28
- ^ A b C. U. Schwermer, G. Lavik, RMM Abed, B. Dunsmore, TG Ferdelman, P. Stoodley, A. Gieseke, D. de Beer: Impactul azotatului asupra structurii și funcției comunităților de biofilme bacteriene în conductele utilizate pentru injecție de apă de mare în câmpurile petroliere. În: Microbiologie aplicată și de mediu. 74 (2008), pp. 2841-2851. (online) .
- ↑ VDI 2047 foaia 2: 2015-01 plante de răcire; Asigurarea funcționării igienice a sistemelor de răcire prin evaporare (regulile turnului de răcire VDI) (sisteme de răcire deschise; asigurarea funcționării sănătoase din punct de vedere igienic a sistemelor de răcire evaporativă (Codul de practică al turnului de răcire VDI)) Beuth Verlag, Berlin. P. 11.
- ↑ VDI 3478 foaia 2: 2008-04 Curățarea biologică a gazelor de eșapament; Reactoare cu pat Bioriesel (Purificare biologică a gazelor reziduale; Reactoare cu pat biologic). Beuth Verlag, Berlin. P. 12.
- ↑ Jürgen Koppe, Stefan Winkens: Conformitate deplină cu VDI 6022 - posibilă prin catalizatori în stare solidă în dezinfectarea H 2 O 2 a umidificatoarelor de aer . În: HLH ventilație / aer condiționat, încălzire / canalizare, tehnologie de construcție . Vol. 59, nr. 2, 2008, ISSN 1436-5103 , pp. 22-27.
- ↑ Centrul de informații pentru protecția mediului corporativ (IBU) ( Memento din 16 ianuarie 2017 în Arhiva Internet )
- ↑ Simone Schulte: Eficacitatea peroxidului de hidrogen împotriva biofilmelor , disertație la Universitatea din Duisburg-Essen, 2003.
- ^ Till Elgeti, Sebastian Janning, Jan Koppe, Jürgen Koppe: Cataliză indusă de lumină în tratarea apei. În: WLB. 05/2010. (online) ( pagina nu mai este disponibilă , căutați în arhivele web ) Informații: linkul a fost marcat automat ca defect. Vă rugăm să verificați linkul conform instrucțiunilor și apoi să eliminați această notificare. .
- ↑ Timothy K. Lu, James J. Collins: Dispersarea biofilmelor cu bacteriofag enzimatic proiectat . În: Proceedings of the National Academy of Sciences din SUA . Vol. 104, nr. 27, 2007, ISSN 0027-8424 , PMID 17592147 , doi: 10.1073 / pnas.0704624104 , pp. 11197-11202. (Fișier PDF; 1,7 MB) .
- ↑ Jemy A. Gutierrez, Tamara Crowder și colab.: Analogii stării de tranziție a 5'-metiltioadenozin nucleozidazei întrerup sensul cvorumului . În: Nature Chemical Biology . Publicat online, 8 martie 2009, doi: 10.1038 / nchembio.153
- ↑ Barbara W. Trautner, Richard A. Hull și colab.: Acoperirea cateterelor urinare cu o tulpină avirulentă de Escherichia coli ca mijloc de stabilire a colonizării asimptomatice . În: Controlul infecțiilor și epidemiologia spitalului . Vol. 28, nr. 1, 2007, ISSN 0899-823X , PMID 17230395 , doi: 10.1086 / 510872 , pp. 92-94.
- ↑ Zadik Hazan, Jona Zumeris și colab.: Prevenirea eficientă a formării biofilmului microbian pe dispozitivele medicale prin unde acustice de suprafață cu energie scăzută . În: Agenți antimicrobieni și chimioterapie . Vol. 50, nr. 12, 2006, ISSN 0066-4804 , PMID 16940055 , doi: 10.1128 / AAC.00418-06 , pp. 4144-4152.
(FSE) Georg Fuchs, Hans Günter Schlegel, Thomas Eitinger: Microbiologie generală . A 9-a ediție complet revizuită și extinsă. Georg Thieme Verlag, Stuttgart 2014, ISBN 978-3-13-444609-8 .