Gluconeogeneză
| Mamă |
| Metabolismul glucozei |
| Ontologie genică |
|---|
| QuickGO |
Gluconeogeneza ( latinisierte cazul gluconeogenezei , un cuvânt compus din antice grecești γλυκύς glykys „dulce“, νέος Neos „nou“ și γένεσις geneza „generație“) este formarea de D - glucoză din precursori non-carbohidrați organici, cum ar fi piruvat , oxaloacetat și dihidroxiacetonă fosfat . Calea metabolică poate fi găsită universal în toate ființele vii. La om și vertebrate , materiile prime sunt aminoacizii care provin din descompunerea proteinelor . Plantele , ciupercile , majoritatea bacteriilor și unele nevertebrate pot folosi ciclul glioxilat pentru a produce glucoză din acetil-CoA și astfel din acizi grași .
Nevoia de gluconeogeneză la om
Necesarul zilnic de glucoză al unei persoane adulte este de aproximativ 200 g în repaus, din care 75% este utilizat de creier și o mare parte din restul de către eritrocite . Cantitatea de glicogen stocată în organism este de aproximativ 400 până la 450 g. Aproximativ două treimi din aceasta este stocată în mușchi și aproximativ o treime în ficat. Cantitatea disponibilă de glucoză din sânge este de aproximativ 5 mmol / L, ceea ce corespunde la aproximativ 900 mg / L sau 90 mg / dL.
Cei eritrocitele de oameni și mamifere nu au mitocondrii și sunt , prin urmare , complet dependentă de furnizarea de glucoza pentru a genera energie, pe care le rupe în jos prin glicoliză și ulterior fermentarea acidului lactic . Creierul își îndeplinește nevoia enormă de energie rapid disponibilă, în principal prin descompunerea glucozei. Acesta este principalul motiv pentru care sinteza glucozei începe chiar și în perioade relativ scurte de foame, care are loc în principal în ficat și în cortexul renal și mai puțin în creier, schelet și mușchii inimii. Datorită acumulării de glucoză în gluconeogeneză, concentrația de glucoză nu scade niciodată sub 3,5 mmol / L (aproximativ 600 mg / L, 60 mg / dL). Se pot forma aproximativ 180 până la 200 g de glucoză pe zi.
Curs de gluconeogeneză
Localizare celulară
Cursul gluconeogenezei în eucariote este distribuit în trei compartimente ale unei celule . Majoritatea are loc în citosol . O etapă de reacție are loc în mitocondrie , alta în reticulul endoplasmatic neted (SER după reticulul endoplasmic neted englezesc ), deoarece necesarul pentru fiecare enzimă ( piruvat carboxilaza și glucoza-6-fosfataza ) este prezent doar aici.
Etape de reacție
Materiile prime pentru gluconeogeneză sunt (1) piruvat sau oxaloacetat ca produse de descompunere a aminoacizilor și fermentarea acidului lactic (din lactat ), (2) piruvat format anaerob în mușchi ( ciclul Cori ), (3) dihidroxiacetonă fosfat ca derivat al glicerină din descompunerea grăsimilor sau (4) propionat , care rămâne după ultima etapă de β-oxidare atunci când acizii grași cu număr inegal sunt defalcați . Acesta este transformat de propionil-CoA carboxilază și o racemază (metilmalonil-CoA epimerază) în succinil-CoA , din care se formează oxaloacetat în cursul ciclului acidului citric .
Structura glucozei din L- lactat este prezentată mai jos:
 |
NAD + NADH + H + lactat dehidrogenază  |
 |
HCO 3 - ATP ADP + P i piruvat carboxilaza |
 |
PIB GTP + CO 2 PEPCK |
 |
|
| L- lactat | Piruvat | Oxaloacetat | Fosfoenolpiruvat |
 |
+ H 2 O enolaza  |
 |
Fosfo glicerat mutaza 
|
 |
ATP ADP fosfo glicerat kinaza |

|
| Fosfoenolpiruvat | D - 2-fosfoglicerat | D - 3-fosfoglicerat | D -1,3-bifosfoglicerat |
 |
H 2 O P i fructoză 1,6-bisfosfatază |
 |
Glucoza-6-fosfat izomeraza |
 |
H 2 O P i glucoză-6-fosfatază |

|
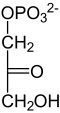
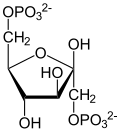
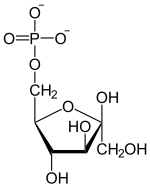
| β- D - fructoză-1,6-bisfosfat | β- D - fructoză-6-fosfat | α- D - glucoză-6-fosfat | α- D - glucoză |
Gluconeogeneza corespunde doar parțial reacției inverse a glicolizei . Cu toate acestea, în glicoliză, există trei reacții în care echilibrul chimic este aproape exclusiv din partea produselor de reacție. Acești pași, catalizați de kinaze , sunt:
- conversia glucozei în glucoză-6-fosfat,
- de la fructoză-6-fosfat la fructoză-1,6-bisfosfat și
- reacția fosfoenolpiruvatului (PEP) la piruvat.
Pentru a inversa aceste reacții, celula ar trebui să poată construi concentrații extreme. Prin urmare, acești trei pași în glicoliză sunt de facto ireversibili și sunt eludați în ordine inversă în gluconeogeneză după cum urmează:
- carboxilarea piruvatului în oxaloacetat utilizând ATP ( piruvat carboxilaza ) și decarboxilarea fosforilantă ulterioară a oxaloacetatului în PEP utilizând GTP (fosfoenolpiruvat carboxicinaza);
- fructoză-1,6-bisfosfatazei catalizează reacția de fructoză-1,6-bifosfat la fructoză-6-fosfat;
- Glucoza-6-fosfatul este transformată în glucoză de glucoza-6-fosfataza (în glicoliză, o hexokinază sau glucokinază (hexokinază IV) catalizează reacția inversă ).
Celelalte procese de conversie sunt în echilibru, motiv pentru care joacă și ele un rol în gluconeogeneză.
O altă diferență importantă față de glicoliză este localizarea reacției. În timp ce acest lucru are loc exclusiv în citosol , gluconeogeneza este distribuită în trei compartimente . Conversia piruvatului în oxaloacetat are loc în lumenul mitocondriei . Oxaloacetatul nu poate trece liber prin membrana interioară a mitocondriei și trebuie mai întâi convertit. Există două moduri de a face acest lucru. Fie oxaloacetatul mitocondrial este transformat în PEP de către o carboxicinază PEP mitocondrială. PEP părăsește apoi mitocondria printr-un sistem special de transfer anionic. În citoplasmă, PEP este transformat în glucoză ca urmare a gluconeogenezei.
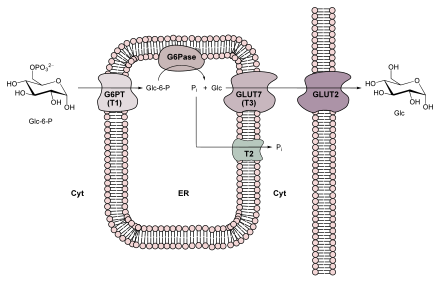
Dacă ți-e foame, este luat un al doilea traseu pentru transport. În ficat , L - alanina este dezaminată în piruvat și servește astfel ca sursă de oxaloacetat. Când îi este foame, cantitatea de agent reducător sub formă de NADH este scăzută în citosol și ridicată în mitocondrie. Cu toate acestea, NADH este necesar în citosol pentru gluconeogeneză. Așa-numitul sistem de navetă malat-aspartat este utilizat pentru a transporta atât NADH, cât și oxaloacetat de la mitocondrie în citosol . Oxaloacetatul generat în mitocondrie este redus la L - malat de către o malat dehidrogenază mitocondrială și poate fi apoi translocat prin membrana interioară. În plus față de naveta malat-aspartat, purtătorul dicarboxilat mitocondrial este, de asemenea, disponibil pentru transport. În citosol, o malat dehidrogenază citosolică oxidează malatul în oxaloacetat, prin care NAD + este redus la NADH și este utilizat în gluconeogeneză.
Ultima etapă de reacție în gluconeogeneză nu are loc în citosol, ci în lumenul reticulului endoplasmatic (ER). Transportul în ER și hidroliza glucozei-6-fosfat este efectuat de un complex membrană-enzimă specific glucozei format din glucoză-6-fosfat translocază și glucoză-6-fosfatază (vezi și figura din dreapta).
Piruvat carboxilaza
Piruvat carboxilaza este activă numai cu grupa sa protetică: biotina . Biotina acționează ca un purtător mobil de dioxid de carbon activ . Biotina este legată de gruparea ε-amino a unui reziduu de lizină specific prin intermediul grupului său carboxi . Acest lucru creează un braț flexibil, care permite grupului de biotină să „se balanseze” de la un centru activ la al doilea. Carboxilarea are loc în doi pași:
Prima reacție parțială depinde de prezența acetil-CoA, fără de care nu este posibilă carboxilarea biotinei. Această reglementare este o formă de alosterie , deoarece un nivel ridicat de acetil-CoA este un semn al unei necesități mai mari de oxaloacetat în ciclul acidului citric. Acetil-CoA este un puternic și singurul efector al enzimei. Oxaloacetatul poate fi utilizat fie pentru glucogeneză, fie este încorporat în ciclul acidului citric . Reacția catalizată a piruvat carboxilazei este un exemplu de reacție anaplerotică . Dacă există un exces de ATP, oxaloacetatul este consumat în gluconeogeneză, ceea ce înseamnă că nu este îmbogățit. A doua etapă de reacție a piruvat carboxilazei este independentă de acetil-CoA.
Comparația gluconeogenezei și glicolizei
Echilibrul energetic comparativ cu inversarea glicolizei
Pentru biosinteza unei molecule de glucoză, pornind de la piruvat, sunt necesare patru molecule de ATP și două molecule fiecare de GTP și NADH.
Bilanțul prezentat mai jos arată clar că reacția superioară va avea loc preferențial, deoarece o inversare directă a glicolizei reprezintă o reacție nefavorabilă termodinamic:
Aceasta înseamnă că sunt necesari șase echivalenți ATP (2 GTP + 4 ATP), astfel încât să poată avea loc gluconeogeneza pentru a forma o moleculă de glucoză.
Gluconeogeneză și glicoliză - reglare reciprocă
Gluconeogeneza și glicoliza împărtășesc mai multe reacții enzimatice, dar sunt două căi metabolice complet opuse. Prin urmare, este nevoie de reglementare. Are loc în două locuri:
- în reacțiile de la piruvat la PEP și
- în conversia fructozei-1,6-bisfosfatului în fructoză-6-fosfatului.
Prima reacție: conversia PEP în piruvat, care are loc în glicoliză, este catalizată de piruvat kinază . Activitatea acestei enzimei este crescută cu fructoză-1,6-bifosfat și inhibat de ATP și alanină. Enzimele gluconeogenezei (piruvat carboxilaza și PEP carboxicinaza) sunt activate de acetil-CoA și inhibate de ADP. Deoarece ATP este transformat în ADP prin hidroliză , acest tip de reglare a două reacții opuse poate fi denumit reglare reciprocă. Un alt exemplu este reacția enumerată la punctul 2. Fosfructructinaza implicată în glicoliză este stimulată de fructoză-2,6-bisfosfat și adenozin monofosfat (AMP), dar este inhibată de citrat , printre altele . Reciproc, are loc reglarea fructozei-1,6-bisfosfatazei implicate în gluconeogeneză (activată de citrat și inhibată de fructoză-2,6-bisfosfat și AMP).
literatură
- Geoffrey Zubay: biochimie. Ediția a IV-a. Mcgraw-Hill Professional, 1999, ISBN 3-89028-701-8 .
- Donald Voet, Judith G. Voet: Biochimie . Wiley-VCH, 1994, ISBN 3-527-29249-7 .
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochimie. Ediția a 6-a. Spectrum Akademischer Verlag, Heidelberg 2007, ISBN 978-3-8274-1800-5 .
- H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn, Carsten Biele (traducător): Biochimie . A 4-a ediție actualizată. Pearson Studies, 2008, ISBN 978-3-8273-7312-0 .
- Reginald Garrett, Charles M. Grisham: Biochimie . (Ediția internațională pentru studenți). Ediția a IV-a. Servicii de învățare Cengage , 2009, ISBN 978-0-495-11464-2 .
- David L. Nelson, Michael M. Cox, Albert L. Lehninger (primul): Lehninger Biochemie . 4, complet revizuit și exp. Ediție. Springer, Berlin 2009, ISBN 978-3-540-68637-8 .
Link-uri web
Dovezi individuale
- ↑ Gerd P. Püschel, Hartmut Kühn, Thomas Kietzmann, Wolfgang Höhne, Bruno Christ: Pocket Textbook Biochimie . Prima ediție. Georg Thieme Verlag, 2018, ISBN 9783132429031 , p. 252.
- ^ BH Robinson: Transportul fosfoenolpiruvatului prin sistemul de transport al tricarboxilatului în mitocondriile mamiferelor. În: FEBS Lett . 14 (5), 1971, pp. 309-312. PMID 11945784 .
- ↑ S. Jitrapakdee, M. St. Maurice și colab.: Structura, mecanismul și reglarea piruvatului carboxilazei. In: Biochem . 413 (3), 2008, pp. 369-387. PMID 18613815 ; doi: 10.1042 / BJ20080709 .
- ^ H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn, Carsten Biele (traducător): Biochimie. A 4-a ediție actualizată. Pearson Studium, 2008, ISBN 978-3-8273-7312-0 , p. 483.
- ↑ Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochimie. 6 ediție. Spektrum Akademischer Verlag, Heidelberg 2007, ISBN 978-3-8274-1800-5 , p. 518.