Cinetică (chimie)

De cinetică este o porțiune a chimiei fizice , care în macrokinetics este divizată și cinetica moleculare. Cinetica moleculară se ocupă de sincronizarea reacțiilor chimice la nivel molecular și include microcinetica, care se ocupă cu cinetica reacțiilor elementare . Macrokinetica ia în considerare influența proceselor de transport al căldurii și materialelor macroscopice asupra cineticii reacțiilor chimice și reprezintă astfel legătura dintre cinetica reacțiilor și ingineria reacțiilor chimice . Acest articol tratează cinetica moleculară a reacțiilor chimice. Cinetica proceselor electrochimice este tratată în articolul cineticii electrochimice .
Viteza de reacție
definiție

Dimensiunea de bază a cineticii vitezei de reacție ( English rate of reaction ) cu dimensiunea molului pe timp și volum . Unitatea vitezei de reacție derivată din cantitățile de bază ale sistemului internațional de unități este mol pe metru cub și secundă . Viteza de reacție indică variația variabilei de conversie (cantitatea de reacție evenimente, care sunt definite prin reacția ecuația reacției avute în vedere, în mol) pe unitatea de timp și de volum în condiții izocoră. Dacă numărul stoichiometric și valoarea numărului stoichiometric unei substanțe implicate în reacție luate în considerare sunt i , atunci pentru o reacție
viteza de reacție r este egală cu:
Aici, t este timpul de reacție, V este volumul de reacție și [A], [B], [K] și [L] sunt concentrațiile substanțelor legate de volum ale substanțelor A, B, K și L implicate în reacție Coeficientul diferențial este egal cu panta profilului concentrație-timp subiacent [A] ( t ), care reprezintă [A] în funcție de t . Deoarece A este consumat ca materie primă, schimbarea diferențială a concentrației d [A] și, astfel, coeficientul diferențial sunt negative. Deoarece numărul stoechiometric al unui material de pornire are, de asemenea, un semn negativ conform convenției, expresia și, astfel, viteza de reacție sunt pozitive.
Legile vitezei și legile timpului
Legile vitezei
Dependența vitezei de reacție de concentrațiile reale ale reactanților într- o reacție este descrisă empiric de legile vitezei. Legile ratei conțin de obicei o constantă a ratei k sau un timp de înjumătățire t 1/2 , care reprezintă cinetica procesului chimic luat în considerare într-un mod caracteristic. Timpul de înjumătățire indică perioada în care concentrația inițială [A] 0 a unui reactant A scade la jumătate din valoare.
Reacțiile gross observabile fenomenologic pot avea mecanisme complexe de reacție care cuprind secvențe ale mai multor reacții elementare reversibile. Exemple în acest sens sunt reacțiile care urmează mecanismul Lindemann , reacțiile în lanț sau reacțiile catalizate de enzime care pot fi descrise de teoria Michaelis-Menten . Mai mult, viteza de reacție observabilă poate fi influențată de reacțiile competitive. Deoarece legile de viteză descriu astfel în mare parte evenimente complexe de reacție, nu se pot trage concluzii direct despre ele despre mecanismul de reacție. Adesea legile de viteză sunt formulate pe baza unor modele de reacție simplificate. De exemplu, cinetica reacțiilor compozite care cuprind mai multe reacții elementare consecutive poate fi dominată de o reacție elementară deosebit de lentă ca etapă de determinare a vitezei. În acest caz, cinetica reacției compozite este adesea reprezentată într-o manieră satisfăcătoare de cinetica mai simplă a reacției elementare deosebit de lente. Dacă intermediarii reactivi apar în cursul reacțiilor, principiul cvasi-staționar al lui Bodenstein poate fi aplicat.
Legile timpului
Legile timpului sau ecuațiile de viteză indică variabila de conversie a unei reacții sau concentrația unei substanțe implicate într-o reacție în funcție de timpul de reacție. În unele cazuri, legile timpului reacțiilor chimice pot fi determinate din legile de viteză respective prin separarea și integrarea variabilelor. În schimb, legile vitezei sunt primele derivate ale legilor timpului corespunzătoare. Timpurile de înjumătățire pot fi determinate direct din legile timpului.
Dependența de temperatură a vitezei de reacție
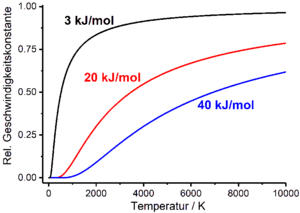
Ratele de reacție depind practic de variabilele de stare care caracterizează sistemul de reacție, cum ar fi temperatura T , presiunea și volumul. Această dependență își găsește drumul în legile de viteză ale proceselor chimice prin constanta de viteză sau timpul de înjumătățire, care la rândul lor sunt funcții de temperatură, presiune și volum. În practică, dependența de temperatură a vitezei de reacție este deosebit de relevantă. Aceasta este descrisă empiric prin ecuația Arrhenius , care leagă rata constantă de temperatură. Ecuația Arrhenius este o funcție exponențială care conține un factor pre-exponențial A cu dimensiunea constantei de viteză și energia de activare molară E A în exponent ca parametri empirici ( R este constanta generală a gazului ):
Dacă se presupune aproximativ că factorul pre-exponențial al ecuației Arrhenius și energia de activare sunt independente de temperatură, constanta de rată tinde spre zero atunci când temperatura tinde spre zero și către factorul pre-exponențial când temperatura tinde spre infinit . Factorul pre-exponențial reprezintă astfel valoarea maximă pe care o poate asuma constanta de viteză.
În mod similar, ecuația Arrhenius poate fi utilizată și pentru a arăta cum depinde timpul de înjumătățire de temperatură. Ecuația lui Arrhenius are apoi un exponent cu semn pozitiv:
Factorul pre-exponențial A ', ca și timpul de înjumătățire, are dimensiunea timpului. Timpul de înjumătățire se apropie de infinit atunci când temperatura se apropie de zero și față de factorul pre-exponențial atunci când temperatura se apropie de infinit. Factorul pre-exponențial reprezintă astfel valoarea minimă pe care o poate asuma timpul de înjumătățire.
Stări de tranziție și energii de activare
Stări tranzitorii
În cursul unui eveniment de reacție elementar, sistemul de reacție parcurge o traiectorie pe o hipersuprafață potențială, care se caracterizează prin modificări structurale succesive, cum ar fi schimbări în unghiurile de legătură și lungimile legăturii. Conform teoriei stării de tranziție , se depășește un perete potențial care separă materialele de pornire și produsele (bariera de activare), ceea ce reprezintă un punct de șa pe potențialul suprafață. Stările prin care trece sistemul de reacție în timpul reacției elementare luate în considerare sunt descrise cel mai adecvat de potențialul termodinamic aplicabil respectiv , care descrie schimbările de entropie din univers cauzate de modificările sistemului de reacție . Dacă presiunea și temperatura sunt menținute constante, aceasta este entalpia liberă . Punctul de șa este locația celei mai mari entalpii libere prin care trece sistemul de reacție în cursul unui eveniment de reacție elementar. Starea pe care sistemul de reacție și-o asumă atunci când trece prin punctul de șa se numește starea de tranziție . Entalpia liberă molară de activare reprezintă nivelul barierei potențiale care trebuie depășită pentru conversia materiilor prime în produse, adică diferența dintre entalpiile libere ale stării de tranziție și starea inițială înainte de începerea evenimentului de reacție elementar . Mărimea constantei de viteză , care reprezintă cinetica conversiei materiilor prime în produse, depinde de (a se vedea secțiunea „ Formulare termodinamică ” din articolul „Teoria stării de tranziție”):
În mod corespunzător, următoarele se aplică dependenței constantei de viteză a reacției inverse de entalpia sa de activare liberă :
Entalpii libere de activare și echilibru termodinamic

Multe reacții sunt reacții de echilibru în care, pe lângă formarea produselor de reacție prin reacția directă, reacția inversă creează și noi materiale de pornire din produsele de reacție:
A furnizat reacția directă cu entalpia de activare fără molar și entalpia de reacție fără molar
și reacția inversă cu entalpia liberă de activare
rulează exact de-a lungul aceleiași traiectorii de reacție în direcții opuse, următoarele se aplică entalpiei de activare liberă molară a reacției directe:
Constanta de viteză a reacției directe este apoi:
Pentru raportul dintre K față și k rueck urmează:
Simplificarea are ca rezultat:
Prin urmare:
Aici, K este constanta de echilibru termodinamic a reacției luate în considerare. Constantele de viteză k pentru reacția directă și k înapoi pentru reacția inversă sunt astfel cuplate între ele - raportul este determinat de constanta de echilibru termodinamic. Această relație este adesea interpretată greșit în sensul că constanta de echilibru a unei reacții de echilibru depinde de constantele de viteză ale reacțiilor înainte și înapoi. Cu toate acestea, această idee se bazează pe un pre-concept incorect . Mărimile termodinamice, care, la fel ca entalpia liberă de reacție și constanta de echilibru, descriu schimbări de stare, depind exclusiv de starea inițială și finală, dar nu de calea pe care o ia sistemul de la starea inițială la starea finală.
Energiile de activare
Existența unor bariere potențiale, care trebuie depășite în cursul unei reacții brute fenomenologic observabile în timpul conversiei materiilor prime în produse, este reprezentată empiric de ecuația Arrhenius. Spre deosebire de ecuația Eyring rezultată din teoria stării de tranziție, ecuația Arrhenius nu ia în considerare nici numărul, nici natura stărilor de tranziție care trebuie trecute de sistemul care reacționează, ci reprezintă barierele potențiale care trebuie depășite de către parametru fenomenologic energie de activare. Dacă energia de activare se apropie de infinit la temperatură constantă, constanta vitezei converge la zero conform ecuației Arrhenius. Energia de activare este egal cu zero, constanta de viteză egală cu pre-exponențial factor A . În mod similar, ecuația Arrhenius poate fi utilizată și pentru a arăta cum depinde timpul de înjumătățire de energia de activare. Dacă energia de activare se îndreaptă spre infinit la temperatură constantă, timpul de înjumătățire se îndreaptă și spre infinit. Dacă energia de activare este zero, timpul de înjumătățire devine egal cu factorul pre-exponențial A ' .
În general, la temperatură constantă, viteza de reacție crește dacă energia de activare este redusă. În cataliza reacțiilor chimice, sunt furnizate traiectorii alternative de reacție care conduc la o reducere a energiei de activare. Acest lucru permite obținerea unor viteze mai mari de reacție fără a fi nevoie să creșteți temperatura de reacție în acest scop.
Dacă profilurile concentrație-timp sunt determinate pentru o reacție la mai multe temperaturi și constantele de viteză k ( T ) sunt determinate experimental din acestea , se poate determina și energia de activare. Luarea logaritmului convertește ecuația Arrhenius într-o ecuație dreaptă :
Graficul logaritmului natural ln k ( T ) al constantei ratei determinate experimental k ( T ) împotriva rezultă într-o linie dreaptă, a cărei pantă corespunde energiei de activare negativă. Intersecția dreptei cu axa y este logaritmul ln A al factorului pre-exponențial al ecuației Arrhenius.
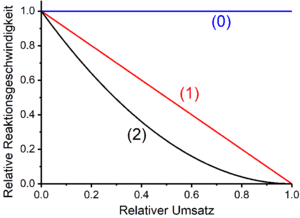
Reacții zero până la ordinul III
În multe cazuri, viteza reacțiilor chimice care implică materiile prime este proporțională cu produsele funcțiilor de putere ale concentrațiilor materiilor prime :
Unde este rata constantă. Exponenții sunt ordinele de reacție parțiale în raport cu materiile prime . Suma este ordinea generală a reacției în cauză. Ordinele parțiale de reacție pot avea, dar nu trebuie, să aibă aceleași cantități ca numerele stoichiometrice ale materialelor de pornire în cauză într-o reacție. Numerele stoichiometrice ale materialelor de pornire care apar în ecuațiile de reacție brute reprezintă adesea stoichiometria totală a reacțiilor compozite care cuprind mai multe reacții elementare. Ordinele de reacție parțiale și, astfel, ordinele de reacție generale rezultă adesea, ca în cazul substituțiilor nucleofile și eliminărilor de ordinul întâi, din reacțiile elementare de determinare a ratei, a căror stoichiometrie diferă de stoichiometria reacției generale luate în considerare. Dacă o reacție grosieră , cum ar fi reacțiile în lanț radicale , cuprinde reacții elementare suprapuse sau cuplate fără o reacție elementară lentă și astfel limitativă a ratei, ordinele de reacție parțiale pot diferi de asemenea de numărul stoichiometric al componentelor în cauză. Ordinele de reacție rupte apar și în astfel de cazuri.
Legile timpului care rezultă pentru reacțiile cu o primă sau mai mare ordine de reacție generală pot fi convertite în ecuații de linie dreaptă prin transformări (a se vedea tabelul de mai jos ; pentru reacțiile de ordin zero, profilurile de concentrație-timp sunt întotdeauna liniare). Legile timpului prezentate în această formă pot fi comparate cu concentrațiile [A] ( t ) ale unui reactant A măsurate după diferiți timpi de reacție pentru determinarea experimentală a ordinii generale a reacției . Cantitatea de pantă a liniei drepte obținută în acest mod corespunde produsului numărului stoichiometric al materialului de pornire și constantei de viteză .
Prezentare generală
Legile timpului, graficele liniarizate ale legilor timpului pentru a determina constanta vitezei și expresiile semnelor de jumătate de valoare sunt rezumate pentru reacțiile cu legile vitezei de tip în tabelul următor, luând în considerare numărul stoechiometric al materialului de pornire . Trebuie remarcat faptul că are un semn negativ. Unitățile constantelor de viteză sunt valabile pentru toate reacțiile cu ordinea generală a reacției n .
| Ordinul 0 | Ordinul 1 | Ordinul 2 | n . Ordin | |
|---|---|---|---|---|
| Legea vitezei | ||||
| Legea timpului |
[ ] |
|||
| Unitatea k | ||||
| Complot liniar al legii timpului | [A] vs. t | vs. t | vs. t |
vs. t
[ ] |
| Jumătate de viață |
[ ] |
Reacții de ordine zero
Rata reacțiilor de ordin zero este independentă de concentrațiile reactanților. Aceasta înseamnă că viteza de reacție este constantă. Prin urmare, legile timpului iau forma unei linii drepte cu o pantă negativă (pentru variabilele de conversie și reactanți) sau cu o pantă pozitivă (pentru produse). Panta liniei drepte corespunde cantității constantei de viteză k . Exemple de reacții de ordin zero sunt anumite reacții fotochimice și catalitice . De exemplu, oxidarea biologică a etanolului în acetaldehidă de către anumite alcool dehidrogenaze este de ordinul zero în raport cu etanolul. Un alt exemplu este polimerizarea în emulsie , în care, după faza de inițiere, reacția este zero
Reacții de ordinul întâi
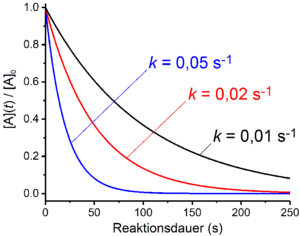
În cazul reacțiilor de primul ordin, viteza reacției depinde liniar de concentrația unui reactant A. Acesta este cazul în care procesul general cuprinde o singură reacție de dezintegrare unimoleculară. Un exemplu în acest sens este decăderea radioactivă . Mai mult, reacțiile care cuprind mai multe reacții elementare sunt de ordinul întâi dacă etapa de determinare a vitezei este un proces de descompunere sau disociere . Exemple în acest sens sunt mecanismul S N1 de substituție nucleofilă sau mecanismul E1 în reacțiile de eliminare . Legea ratei ia următoarea formă pentru o reacție de primul ordin:
Legea timpului de prim ordin se obține separând mai întâi variabilele:
Următorul pas este calcularea integralelor definite:
Mai întâi primești:
Formarea rezultatelor în:
De-logaritmizarea oferă legea timpului pentru reacțiile de ordinul întâi:
Sau:
Dacă, așa cum se întâmplă adesea în cazul reacțiilor de prim ordin, se aplică următoarele
- ,
devine legea timpului pentru reacțiile de primul ordin:
Reacții de ordinul doi
Al doilea ordin sunt reacțiile elementare bazate pe coliziuni bimoleculare. Exemple în acest sens sunt substituțiile nucleofile conform mecanismului S N 2 și eliminările conform mecanismului E2. Dacă procesele de descompunere sau disociere de ordinul întâi se desfășoară și pe parcursul unei reacții în mai multe etape, acestea sunt de obicei etapele de determinare a vitezei, astfel încât, ca în cazul reacțiilor S N 1 și E 1, reacția generală este prima comanda.
Dacă coliziunea bimoleculară are loc cu participarea a două particule similare de specii A, cantitatea numărului stoichiometric al materialului de pornire A este egală cu două, iar ecuația reacției are forma:
Legile privind rata și timpul rezultate, precum și expresia pentru timpul de înjumătățire al [A] ( t ) sunt enumerate în tabelul de mai sus .
Dacă particulele a două specii diferite A și B sunt implicate în coliziunea bimoleculară și valorile absolute ale numerelor stoichiometrice și ale reactanților A și B sunt ambele egale cu una, ecuația reacției devine:
Legea vitezei devine în consecință:
Ca lege a timpului, se obține cu [B] 0 ca concentrație inițială a reactantului B înainte de începerea reacției:
Reacții de ordinul III
Pentru ca o reacție să fie de ordinul trei, aceasta trebuie să implice o coliziune trimoleculară ca reacție elementară. Deoarece coliziunile trimoleculare au o probabilitate scăzută, reacțiile de ordinul trei sunt rare. Apariția reacțiilor de ordinul trei a fost aproximativ legată de reacțiile de recombinare a atomilor și radicalilor de acest tip
- ,
unde M acționează ca un partener de coliziune, precum și pentru reacțiile de monoxid de azot cu halogeni X și oxigen conform
și
postulat.
Votați legile reacțiilor de echilibru
Se are în vedere o reacție de echilibru
- .
Dacă reacțiile înainte și înapoi sunt de ordinul întâi, modificările concentrațiilor și sunt determinate de ecuațiile diferențiale
cu constantele de viteză ale reacției și reacției inverse , precum și starea
Următoarele condiții limită sunt necesare pentru a rezolva acest sistem de ecuații diferențiale:
- : ,
- : ,
Cele două ecuații diferențiale pentru și sunt simplificate de această condiție de limită la:
Aceasta are ca rezultat următoarea lege a timpului integral pentru reacțiile de echilibru de ordinul 1:
Cu
- și
la fel de
rezultă următoarele legi privind viteza:
Măsurarea profilelor concentrație-timp
Cinetica reacțiilor chimice este investigată experimental prin determinarea profilelor concentrație-timp folosind metode analitice cantitative. În acest scop, chimia analitică oferă o gamă largă de metode care evoluează continuu datorită progresului analizei instrumentale și a tehnologiei de microreacție . Variabila măsurată selectată pentru a determina profilul concentrație-timp trebuie să fie proporțională cantitativ cu concentrația componentelor observate. Metodele utilizate frecvent pentru determinarea profilelor concentrație-timp includ măsurarea constantei dielectrice , indicele de refracție , activitatea optică , fluorescența sau conductivitatea soluției de reacție, măsurarea schimbărilor de volum sau de presiune, calorimetrie , precum și absorbția și emisia spectroscopie și împrăștiere a luminii .
Variabila măsurată poate fi observată pe amestecul de reacție în sine, fără contact și fără a lua probe din amestecul de reacție. Această procedură este avantajoasă deoarece minimizează întreruperile în cursul reacției. O altă procedură se bazează pe faptul că alicote sunt luate în mod regulat și de obicei automat din amestecul de reacție . Acestea pot fi supuse unor metode de analiză nedistructivă și apoi combinate din nou cu amestecul de reacție. De asemenea, pot fi utilizate metode de analiză care sunt asociate cu consumul de alicote eliminate. Dacă se iau alicote din amestecul de reacție, se intervine mai puternic în procesul de reacție decât cu metodele fără contact. Cu toate acestea, este avantajos faptul că poate fi utilizat un spectru mult mai larg de metode analitice și pot fi utilizate metode analitice care sunt fie mai sensibile, fie oferă mai multe informații în alt mod decât metodele analitice care pot fi utilizate pentru observarea fără contact a amestec de reacție. Alicotele extrase pot fi, de asemenea, supuse unei analize calitative mai complexe, de exemplu prin separarea componentelor lor folosind cromatografia gazoasă sau cromatografia lichidă de înaltă performanță înainte de examinarea analitică propriu-zisă . În anumite circumstanțe, reacția din alicotele îndepărtate trebuie încetinită sau oprită pentru a preveni falsificarea rezultatelor analitice datorită reacției care continuă după prelevarea probei. Acest lucru se poate face prin răcirea puternică a amestecului de reacție îndepărtat sau prin îndepărtarea unei componente reactive din amestecul de reacție, de exemplu prin precipitare .
Pentru a măsura profilurile de concentrație-timp, reactanții trebuie să fie suficient de amestecați atât de repede încât să poată fi identificat un timp de pornire definit pentru reacția care trebuie investigată. Acest lucru poate fi realizat prin miniaturizarea setărilor experimentale utilizate prin utilizarea tehnologiei de microreacție, deoarece traseele de transport pentru reactanți sunt apoi scurtate. În cazul reacțiilor lente, cantitățile definite de substanță pot fi amestecate folosind agitatoare simple, tuburi de curgere sau camere de amestecare de înaltă precizie. În cazul reacțiilor mai rapide, care se caracterizează prin scale de timp în intervalul de minute până la secunde, sunt adesea utilizate dispozitive speciale de curgere. În cazul reacțiilor extrem de rapide, care se caracterizează prin scale de timp în intervalul de milisecunde, procedeele optimizate, cum ar fi metoda fluxului oprit , sunt utilizate pentru amestecarea rapidă și eficientă a materiilor prime .
Un al doilea grup de metode pentru investigarea reacțiilor extrem de rapide cu scale caracteristice de timp până la gama picosecundelor sunt metodele de relaxare . Acestea se bazează pe principiul amestecării materiilor prime cu mult înainte de perioada efectivă de observare. Amestecul de reacție începe să reacționeze. După ce s-a stabilit o stare de echilibru în amestecul de reacție, aceasta este perturbată de un șoc aplicat rapid și relaxarea amestecului de reacție într-o nouă stare de echilibru este monitorizată folosind metode analitice adecvate. Exemple de procese de relaxare sunt fotoliza flash, precum și procesele de temperatură, presiune și salt pe câmp.
Istoria cineticii
Primele investigații calitative în cinetică au fost raportate de Carl Friedrich Wenzel încă din 1777 în lucrarea sa Theory of the Relationship of Bodies , publicată la Dresda . Mai târziu, Claude-Louis Berthollet și William Higgins s-au ocupat și de probleme cinetice. Prima lucrare cu adevărat fundamentală asupra cineticii, clivajul zahărului din trestie sub influența acidului, a fost prezentată de Ludwig Ferdinand Wilhelmy în 1850. Jacobus Henricus van't Hoff a investigat saponificarea acetatului de etil și hidroliza acidului cloracetic în 1896 . Matematic, el a formulat ecuațiile de viteză ale reacțiilor. De asemenea, el a dezvoltat legile fundamentale privind dependența de temperatură a vitezei de reacție. Svante Arrhenius a îmbunătățit derivarea și a oferit, de regulă , modificarea vitezei de reacție atunci când temperatura a crescut cu 1 K o creștere a vitezei de reacție de aproximativ 12% (a se vedea regula RGT ). FEC Scheffer și WF Brandsma au introdus energia de activare standard Gibbs pentru rata constantă în 1926. Manfred Eigen , Ronald Norrish și George Porter au primit Premiul Nobel pentru chimie în 1967 pentru dezvoltarea metodelor de relaxare pentru a studia cinetica reacțiilor rapide .
literatură
Manuale generale
cinetica
- Margaret Robson Wright: O introducere în cinetica chimică . John Wiley & Sons, Ltd, Chichester, UK 2004, ISBN 978-0-470-09060-2 , doi : 10.1002 / 047009060x.ch1 .
- Bernd Ralle, Ingo Eilks, Alfred Flint, Hartwig Möllencamp, Helmut Wenck: Manual de chimie experimentală: Nivel secundar superior II.8 , cinetică, cataliză, echilibru . Ed.: Bernd Ralle, Ingo Eilks, Wolfgang Glöckner, Walter Jansen, Rudolf G. Weissenhorn. Aulis-Verlag Deubner, Köln 2004, ISBN 3-7614-2384-5 .
- Carl Heinz Hamann, Dirk Hoogestraat, Rainer Koch: Bazele cineticii: de la procesele de transport la reacția cinetică . Springer-Verlag, Berlin 2017, ISBN 978-3-662-49393-9 , doi : 10.1007 / 978-3-662-49393-9 .
- M. Dieter Lechner: Introducere în cinetică: cinetica reacției chimice și proprietățile de transport . Springer-Verlag, Berlin / Heidelberg 2018, ISBN 978-3-662-57454-6 , doi : 10.1007 / 978-3-662-57455-3_1 .
Link-uri web
- GJ Lauth: Introducere în cinetica reacțiilor . Seria de prelegeri, înregistrări video, 2013.
Dovezi individuale
- ^ KJ Laidler: Un glosar al termenilor folosiți în cinetica chimică, inclusiv dinamica reacțiilor (Recomandările IUPAC 1996) . În: Chimie pură și aplicată . bandă 68 , nr. 1 , 1 ianuarie 1996, ISSN 1365-3075 , pp. 149-192 , doi : 10.1351 / pac199668010149 .
- ↑ Intrarea pe viteza de reacție . În: IUPAC Compendium of Chemical Terminology („Cartea de aur”) . doi : 10.1351 / goldbook.R05156 Versiune: 2.3.3.
- ↑ DIN 13345-1978-08 Termodinamica și cinetica reacțiilor chimice: simboluri, unități.
- ↑ Carl Heinz Hamann, Dirk Hoogestraat, Rainer Koch: Fundamentele cineticii: de la procesele de transport la cinetica reacției . Springer-Verlkag, Berlin / Heidelberg 2017, ISBN 978-3-662-49392-2 , p. 116 , doi : 10.1007 / 978-3-662-49393-9 .
- ↑ M. Dieter Lechner: Introducere în cinetică - cinetica reacției chimice și proprietățile de transport . Springer-Verlag, Berlin / Heidelberg 2018, ISBN 978-3-662-57454-6 , pp. 13 , doi : 10.1007 / 978-3-662-57455-3_1 .
- ↑ Christos Capellos, Benon HJ Bielski: Sisteme cinetice: descriere matematică a cineticii chimice în soluție . Wiley-Interscience, 1972, ISBN 0-471-13450-3 , 9780471134503.
- ^ Robert G. Mortimer: Chimie fizică . Academic Press, 2000, ediția a II-a, capitolul 12 Viteza reacțiilor chimice , p. 408.
- ↑ Ignacio Tinoco Jr., James C. Wang: Chimia fizică: principii și aplicații în științele biologice . Prentice Hall, 1995, ediția a III-a, p. 331, ISBN 978-0-13-186545-7 .
- ↑ Emulsie de stiren-butil acrilat Alisa Gapchenko : Aspecte ale copolimerizării la temperaturi ridicate și noi domenii de aplicare Disertație de la Departamentul de chimie al Facultății de matematică, informatică și științe naturale de la Universitatea din Hamburg 2018, accesat pe 29 august 2020
- ↑ Lothar Papula: Exerciții și aplicare la matematică pentru chimiști. Enke Verlag, 1977, pp. 382-385.
- ↑ Klaus H. Homann: 13. Reacții trimoleculare . P. 100-107, în reacția cinetică , Steinkopff-Verlag, Heidelberg 1975, DOI 10.1007 / 978-3-642-72314-8_13, https://doi.org/10.1007/978-3-642-72314-8_13 .
- ↑ VA Kritsman: Ludwig Wilhelmy, Jacobus Henricus van't Hoff, Svante Arrhenius și istoria cineticii chimice. În: Chimia în timpul nostru. Vol. 6, 1997, p. 291 și urm.
- ↑ L. Wilhelmy: Despre legea conform căreia are loc acțiunea acizilor asupra zahărului din trestie. În: Pogg. Ann. 81, 1850, pp. 413-433, 499-526.
- ↑ JH van't Hoff: Studii privind dinamica chimică. W. Engelmann, Leipzig 1896.
- ^ FEC Scheffer, WF Brandsma: Despre viteza de reacție . În: Recueil des Travaux Chimiques des Pays-Bas 1926, 45, 522-534, DOI: 10.1002 / recl.19260450710 .


![{\ displaystyle \ mathrm {d ([A] / [A]} _ {0}) / \ mathrm {d} t}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bffa3007e4f2b8f970aaa310799672465021225b)
![{\ displaystyle 1 / \ nu _ {A} \ cdot \ mathrm {d ([A] / [A]} _ {0}) / \ mathrm {d} t}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9e3ca75e45481f55ca495e47bbe4b3be7bc7732e)
![{\ displaystyle [A] _ {0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/32488af10ddcce5bf90dbc659e6472d1279bd2f0)

![{\ displaystyle \ mathrm {[A]} (t) / \ mathrm {[A]} _ {0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ca8e698d211a4ba286dc5cee735fa102b7a7bd55)





![{\ displaystyle r = {\ frac {\ mathrm {d} \ xi} {V \ mathrm {d} t}} = {\ frac {1} {\ nu _ {\ mathrm {A}}}} {\ frac {\ mathrm {d} [\ mathrm {A}]} {\ mathrm {d} t}} = {\ frac {1} {\ nu _ {\ mathrm {B}}}} {\ frac {\ mathrm { d} [\ mathrm {B}]} {\ mathrm {d} t}} = {\ frac {1} {\ nu _ {\ mathrm {K}}}} {\ frac {\ mathrm {d} [\ mathrm {K}]} {\ mathrm {d} t}} = {\ frac {1} {\ nu _ {\ mathrm {L}}}} {\ frac {\ mathrm {d} [\ mathrm {L} ]} {\ mathrm {d} t}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bad051803386419a21f7dea06cdb06da403dd71b)
![{\ displaystyle \ mathrm {d [A]} / \ mathrm {d} t}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f9c0c0ea6e036d66d87e63ce6eb602371b86bfe5)
![{\ displaystyle 1 / \ nu _ {\ mathrm {A}} \ cdot \ mathrm {d} [\ mathrm {A}] / \ mathrm {d} t}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bf7715affb2ac61f59c17ce855a4a55881e1c44f)




![{\ displaystyle k _ {\ mathrm {hin}} = \ mathrm {constant} \ cdot \ exp {\ bigg [} - {\ frac {\ Delta G _ {\ mathrm {hin}} ^ {\ ddagger}} { RT}} {\ Bigg]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d5c9f480d805db3e9bbb726e9cd6521c8248b45c)


![{\ displaystyle k _ {\ mathrm {back}} = \ mathrm {constant} \ cdot \ exp {\ bigg [} - {\ frac {\ Delta G _ {\ mathrm {back}} ^ {\ ddagger}} { RT}} {\ Bigg]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/996f2f2265eaf4f43a856ff25e62b754618d01d2)







![{\ displaystyle k _ {\ mathrm {hin}} = \ mathrm {constant} \ cdot \ exp {\ Bigg [} - {\ frac {\ Delta G _ {\ mathrm {hin}} ^ {\ ddagger}} { RT}} {\ Bigg]} = {\ rm {Constant}} \ cdot \ exp {\ Bigg [} - {\ frac {\ Delta _ {\ mathrm {R}} G + \ Delta G _ {\ mathrm { înapoi}} ^ {\ ddagger}} {RT}} {\ Bigg]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/46deb04cc6c2e21d23d1750099acd9d4655f653f)
![{\ displaystyle {\ frac {k _ {\ mathrm {hin}}} {k _ {\ mathrm {back}}}} = \ exp {\ Bigg [} - {\ frac {\ Delta _ {\ mathrm {R }} G + \ Delta G _ {\ mathrm {back}} ^ {\ ddagger}} {RT}} {\ Bigg]} \ cdot \ exp {\ Bigg [} - {\ frac {\ Delta G _ {\ mathrm {back}} ^ {\ ddagger}} {RT}} {\ Bigg]} ^ {- 1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6d0c937190983564e5f3238b3653b11c21aba01f)
![{\ displaystyle {\ frac {k _ {\ mathrm {hin}}} {k _ {\ mathrm {back}}}} = \ exp {\ Bigg [} - {\ frac {\ Delta _ {\ mathrm {R }} G + \ Delta G _ {\ mathrm {back}} ^ {\ ddagger}} {RT}} {\ Bigg]} \ cdot \ exp {\ Bigg [} {\ frac {\ Delta G _ {\ mathrm {back}} ^ {\ ddagger}} {RT}} {\ Bigg]} = \ exp {\ Bigg [} {\ frac {- \ Delta _ {\ mathrm {R}} G- \ Delta G _ {\ mathrm {back}} ^ {\ ddagger} + \ Delta G _ {\ mathrm {back}} ^ {\ ddagger}} {RT}} {\ Bigg]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/19aee0e077431b30b517a0760d126364d510da1c)
![{\ displaystyle {\ frac {k _ {\ mathrm {hin}}} {k _ {\ mathrm {back}}}} = \ exp {\ Bigg [} - {\ frac {\ Delta _ {\ mathrm {R }} G} {RT}} {\ Bigg]} = K}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4c6dd0c1a99fdc736c3396a036e5aed97386036f)





![{\ displaystyle 1- [A] / (| \ nu _ {A} | \ cdot [A] _ {0})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/337110c425d9c31781976d98d5121f691087562b)


![{\ displaystyle [Z_ {j}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c8371401c82dcc3aba0f55a69dea98fb83f508dd)
![{\ displaystyle r = k \ prod _ {j = 1} ^ {N} [Z_ {j}] ^ {z_ {j}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4d33d1a831b5329307dcc16ef3df66aab63d11df)






![{\ textstyle r = k [A] ^ {n}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2ee72b44104719c87638869353382dde6b7f8cc0)
![{\ displaystyle 1 / \ nu _ {A} \ cdot {\ rm {d [{\ ce {A}}]}} / {\ rm {d}} t = k}](https://wikimedia.org/api/rest_v1/media/math/render/svg/39e8cc74543ef3ac1f13274623329b23eb33baf7)
![{\ displaystyle 1 / \ nu _ {A} \ cdot {\ rm {d [{\ ce {A}}]}} / {\ rm {d}} t = k [{\ ce {A}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c9878fd8b07099ed2ad2df3657fa82599cab62ff)
![{\ displaystyle 1 / \ nu _ {A} \ cdot {\ rm {d [{\ ce {A}}]}} / {\ rm {d}} t = k [{\ ce {A}}] ^ {2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cae8322c5652dc81065bb686e5e94bf4ff9e497c)
![{\ displaystyle 1 / \ nu _ {A} \ cdot {\ rm {d [{\ ce {A}}]}} / {\ rm {d}} t = k [{\ ce {A}}] ^ {n}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c770fe40a51f2382df8b5a0c6cb44ec5e06938d9)
![{\ displaystyle {[A] = [A] _ {0}} + \ nu _ {A} kt}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a1cfec393e27b6c633c59222dd414410324037ec)
![{\ displaystyle {[A] = [A] _ {0}} \ mathrm {e} ^ {\ nu _ {A} kt}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/268290509ca296b465849ac2cd010a76e1bd892b)
![{\ displaystyle {[A] = 1 / {\ bigg (} {\ frac {1} {[A] _ {0}}} - \ nu _ {A} kt} {\ bigg)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/58905a0ab28598add085990bdd15e9dab39d69cb)
![{\ displaystyle {\ frac {1} {[A] ^ {n-1}}} = {\ frac {1} {{[A] _ {0}} ^ {n-1}}} - (n- 1) \ nu _ {A} kt}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8b4b7805bb5edb6cda3e713e63edc1d2b2e84769)





![{\ displaystyle \ ln ([A] / [A] _ {0})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f9501c936cb1f4ae7bd4d9d5475c56e7c8eaf6ae)
![{\ displaystyle {\ ce {{\ frac {1} {[A]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/104bf3c6ecace101c498f948eaf16bf55240619f)
![{\ displaystyle {\ ce {\ frac {1} {[A] ^ {{\ mathit {n}} - 1}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9cca86ad925386e3c962305fa7ad13100633146e)
![{\ displaystyle t_ {1/2} = - {\ frac {[A] _ {0}} {2 \ nu _ {A} k}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/02f64ec9dd157d200ae582077ad93ce84a9d68df)

![{\ displaystyle t_ {1/2} = - {\ frac {1} {\ nu _ {A} k {\ ce {[A] 0}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7aff34862949fc5d8ea01bd0d3a2ff2901d655a7)
![{\ displaystyle t_ {1/2} = - {\ frac {2 ^ {n-1} -1} {(n-1) \ nu _ {A} k {\ ce {[A] 0}} ^ { n-1}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2c7217aefb2c55f85e584e77ecd1b0fef32f132f)
![{\ displaystyle r = {\ frac {1} {\ nu _ {\ mathrm {A}}}} \ cdot {\ frac {\ mathrm {d} [\ mathrm {A}]} {\ mathrm {d} t }} = k \ cdot [\ mathrm {A}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e908ce8bb4236d61fcd34cc8fc0d5173cf379577)
![{\ displaystyle {\ frac {1} {\ nu _ {\ mathrm {A}}}} \ cdot {\ frac {1} {[\ mathrm {A}]}} \ cdot \ mathrm {d} [\ mathrm {A}] = k \ cdot {\ mathrm {d} t}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/991edf9e54347c2c08d1830272a2e92ba08fce32)
![{\ displaystyle {\ frac {1} {\ nu _ {\ mathrm {A}}}} \ cdot \ int _ {[A] _ {0}} ^ {[A] (t)} {\ frac {1 } {[\ mathrm {A}]}} \ cdot \ mathrm {d} [\ mathrm {A}] = \ int _ {0} ^ {t} k \ cdot {\ mathrm {d} t}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/701a42c632484c2e2d79bd52e380e9b359c96042)
![{\ displaystyle {\ frac {1} {\ nu _ {\ mathrm {A}}}} \ cdot \ mathrm {ln} {\ frac {[\ mathrm {A}] (t)} {[\ mathrm {A }] _ {0}}} = k \ cdot t}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0d551323f3783a9fc6574a26d4484d027f386576)
![{\ displaystyle \ mathrm {ln} {\ frac {[\ mathrm {A}] (t)} {[\ mathrm {A}] _ {0}}} = \ nu _ {\ mathrm {A}} \ cdot k \ cdot t}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9f796056d29939a185616b3a4f05d2adcb658b98)
![{\ displaystyle {\ frac {[\ mathrm {A}] (t)} {[\ mathrm {A}] _ {0}}} = \ mathrm {e} ^ {\ nu _ {\ mathrm {A}} \ cdot k \ cdot t}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae2e4fa3cf7302b1d134600b6b2117bfa4fab090)
![{\ displaystyle [\ mathrm {A}] (t) = {[\ mathrm {A}] _ {0}} \ cdot \ mathrm {e} ^ {\ nu _ {\ mathrm {A}} \ cdot k \ cdot t}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9737a380ff3c23262245168d953f8a1e9e9f77f8)

![{\ displaystyle [\ mathrm {A}] (t) = {[\ mathrm {A}] _ {0}} \ cdot \ mathrm {e} ^ {- k \ cdot t}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/55eda391a671d77366d42c755b6a3ff960dbb78c)




![{\ displaystyle r = - {\ frac {\ mathrm {d} [\ mathrm {A}]} {\ mathrm {d} t}} = - {\ frac {\ mathrm {d} [\ mathrm {B}] } {\ mathrm {d} t}} = k \ cdot [\ mathrm {A}] \ cdot [\ mathrm {B}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/30dca39ceaa144485ade998b5f8baaadd31e7a26)
![{\ displaystyle [\ mathrm {A}] = {\ frac {[\ mathrm {A}] _ {0} \ cdot \ {[\ mathrm {A}] _ {0} - [\ mathrm {B}] _ {0} \} \ cdot \ mathrm {e} ^ {\ {[\ mathrm {A}] _ {0} - [\ mathrm {B}] _ {0} \} kt}} {[\ mathrm {A }] _ {0} \ cdot \ mathrm {e} ^ {\ {[\ mathrm {A}] _ {0} - [\ mathrm {B}] _ {0} \} kt} - [\ mathrm {B }] _ {0}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e8d5c4b0ef1a53185d102c1dd94f7ab74a718632)






![{\ displaystyle r_ {a} = {\ frac {\ mathrm {d} \ mathrm {[A]}} {\ mathrm {d} t}} = - k_ {ab} \ cdot [\ mathrm {A}] + k_ {ba} \ cdot [\ mathrm {B}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b33c3d681d36a8ba401f51c998eda7a47e8b4349)
![{\ displaystyle r_ {b} = {\ frac {\ mathrm {d} \ mathrm {[B]}} {\ mathrm {d} t}} = + k_ {ab} \ cdot [\ mathrm {A}] - k_ {ba} \ cdot [\ mathrm {B}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a6c3288025ca1f9080fdc09fa45410c96f6c56d2)




![{\ displaystyle {\ mathrm {d} \ mathrm {[A]}} + {\ mathrm {d} \ mathrm {[B]}} = 0.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7bc2ea0582440f79e7d87f16a5936342d62b3454)

![{\ displaystyle \ mathrm {[A]} = \ mathrm {[A]} _ {0} -x}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4401e232423ffc963599d5f2f5e70a8f344e245e)
![{\ displaystyle \ mathrm {[B]} = \ mathrm {[B]} _ {0} + x}](https://wikimedia.org/api/rest_v1/media/math/render/svg/72ee410f2ae3fa77a5531f88e17c2dc9182b43e7)

![{\ displaystyle \ mathrm {[A]} _ {\ mathrm {eq}} = \ mathrm {[A]} _ {0} -x _ {\ mathrm {eq}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/465f2367618c8aaec6346b3c118fceb4c8610c87)
![{\ displaystyle \ mathrm {[B]} _ {\ mathrm {eq}} = \ mathrm {[B]} _ {0} + x _ {\ mathrm {eq}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2022abf2e4415f0af6e3627153bc01c4800a1a61)




![{\ displaystyle \ mathrm {[A]} _ {\ mathrm {eq}} = (\ mathrm {[A]} _ {0} + \ mathrm {[B]} _ {0}) \ cdot {\ frac { k_ {ba}} {k_ {ab} + k_ {ba}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af23095b20fd67ae2c6b2d4b87a2c446eb9c0c5f)
![{\ displaystyle \ mathrm {[B]} _ {\ mathrm {eq}} = (\ mathrm {[A]} _ {0} + \ mathrm {[B]} _ {0}) \ cdot {\ frac { k_ {ab}} {k_ {ab} + k_ {ba}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/be959c8d2dee36c1f7132ef55c4154506d842439)
![{\ displaystyle \ mathrm {[A]} _ {0} - \ mathrm {[A]} _ {\ mathrm {eq}} = \ mathrm {[B]} _ {\ mathrm {eq}} - \ mathrm { [B]} _ {0} = {\ frac {k_ {ab} \ mathrm {[A]} _ {0} -k_ {ba} \ mathrm {[B]} _ {0}} {k_ {ab} + k_ {ba}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dd30bc67f5774cc5e891cfbbec70c50dad55c4a5)
![{\ displaystyle \ mathrm {[A]} _ {t} = (\ mathrm {[A]} _ {0} + \ mathrm {[B]} _ {0}) \ cdot {\ frac {k_ {ba} } {k_ {ab} + k_ {ba}}} + {\ frac {k_ {ab} \ mathrm {[A]} _ {0} -k_ {ba} \ mathrm {[B]} _ {0}} {k_ {ab} + k_ {ba}}} \ cdot \ mathrm {e} ^ {- (k_ {ab} + k_ {ba}) \ cdot t}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2570fdf8f24e64e349f50eff143bc69ed7babd5d)
![{\ displaystyle \ mathrm {[B]} _ {t} = (\ mathrm {[A]} _ {0} + \ mathrm {[B]} _ {0}) \ cdot {\ frac {k_ {ab} } {k_ {ab} + k_ {ba}}} - {\ frac {k_ {ab} \ mathrm {[A]} _ {0} -k_ {ba} \ mathrm {[B]} _ {0}} {k_ {ab} + k_ {ba}}} \ cdot \ mathrm {e} ^ {- (k_ {ab} + k_ {ba}) \ cdot t}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6b2684fecf6a507155c88200a52b3b563fe1af39)