hemoglobină
| Subunitate a hemoglobinei α | ||
|---|---|---|

| ||
| Hemoglobina A 1 a adulților este formată din 2 lanțuri α (roșii) și 2 lanțuri β (albastre) cu 4 grupe hem (verde), fiecare dintre acestea putând lega o moleculă de O 2 (model conform PDB 1GZX ) | ||
|
Date structurale existente: intrare UniProt | ||
| Structura primară de masă / lungime | 16 kDa pe subunitate; lanțul α 141, lanțul β 146 aminoacizi | |
| Cofactor | Hamm | |
| Identificator | ||
| Numele genelor | HBA1 , HBA2 | |
| ID-uri externe | ||
| Apariție | ||
| Familia de omologie | Beta-2 globină | |
| Taxon părinte | Vertebrate | |
| Subunitatea β a hemoglobinei | ||
|---|---|---|

| ||
| Model sferic al buzunarului hemului subunității β hemoglobinei cu hem, fier (verde) și dioxigen, conform PDB 1GZX | ||
|
Date structurale existente: intrare UniProt | ||
| Proprietățile proteinelor umane | ||
| Structura primară de masă / lungime | 146 aminoacizi | |
| Cofactor | Hamm | |
| Identificator | ||
| Numele genei | HBB | |
| ID-uri externe | ||
| Apariție | ||
| Familia de omologie | Beta-2 globină | |
| Taxon părinte | Vertebrate | |
Hemoglobina (din greaca veche αἷμα haíma , „sânge” și latină globus , „bucată, bilă”), abrevierea Hb , este complexul proteic care conține fier, care este conținut ca pigment de sânge în celulele roșii din sânge ale vertebratelor, leagă oxigenul și îl transportă în fluxul sanguin .
Hemoglobina mamiferelor este un tetramer , este formată din patru globine ca subunități . La adulți, există două Hb α și Hb β în hemoglobina A (Hb A 0 ), cea mai frecventă formă. Cele patru proteine care formează complexul sunt lanțuri de aminoacizi (lanțul α 141 AA ; lanțul β 146 AA) în pliul tipic globinelor, fiecare cu un buzunar în care este legat un complex de fier (II) , hemul . Ionul său de fier este capabil să lege o moleculă de oxigen. Culoarea hemului se schimbă de la roșu închis la roșu deschis. Puterea legăturii este sensibilă la conformația mediului proteic al hemului. Interacțiunile dintre cele patru globine favorizează cele două stări extreme în care întregul complex este fie saturat cu patru molecule de oxigen (în plămâni sau branhii ), fie a renunțat la tot oxigenul. Interacțiunile cu alte molecule susțin atât încărcarea, cât și descărcarea.
Pentru informații despre apariția hemoglobinei și a globinelor similare în regnul animal, consultați Transportorul de oxigen .
poveste
Hemoglobina proteinei de transport a oxigenului a fost descoperită de Friedrich Ludwig Hünefeld în 1840 . În 1851, Otto Funke a descris cristalizarea hemoglobinei prin diluarea sângelui animalului cu apă, etanol sau dietil eter și apoi evaporarea lentă a solventului din soluția proteică obținută („Funkesche Kristalle”). Oxigenarea reversibilă a hemoglobinei a fost raportată pentru prima dată de Felix Hoppe-Seyler în 1866 . Numele de hemoglobină vine și el. Formula structurală a hemului (sau hemului corespunzător), adică complexul de porfirină care conține fier, a fost formulată de chimistul german William Küster încă din 1912 , iar chimistul Hans Fischer a putut dovedi corectitudinea acestei formule structurale în 1928 prin sinteza completă a hemului. În 1930 a primit Premiul Nobel pentru chimie pentru acest lucru. Hemoglobina este una dintre cele mai bune-studiat proteinele, ei structura a fost unul dintre primii care urmează să fie determinată de către Max Perutz et al , în 1959 , cu ajutorul cristalografie cu raze X . Pentru această lucrare, el și John Kendrew au primit Premiul Nobel pentru chimie în 1962 .
structura
Structură de bază nemodificată
Modelul de panglică al hemoglobinei A (HbA) -
două subunități α și β (roșu și albastru) poartă fiecare un hem (model cu tijă, verde) ca grup protetic (conform PDB 1GZX )
Hemoglobinele mamiferelor sunt formate din patru subunități , câte două de tip α și două de tip β. În fiecare dintre aceste subunități este încorporat un grup protetic , unde are loc legarea oxigenului. Prin urmare, o moleculă de complex de hemoglobină poate lega patru molecule de oxigen. Grupul protetic al formei fără oxigen este un complex de fier (II) al protoporfirinei IX, care ocupă cele patru poziții ecuatoriale ale ionului de fier. Ionul de fier se află într-o stare de rotire ridicată și, prin urmare, este puțin prea mare pentru a se potrivi în gaura porfirinei. Deci este puțin sub nivelul inelului. Această hemă b este legată de matricea proteică prin poziția axială a ionului de fier de pe partea inferioară printr-un reziduu de histidină proximal . A doua poziție axială de sus este neocupată și este disponibilă pentru atașarea moleculei de oxigen.
Modificări post-traducătoare
În plus față de diferitele modificări rare ale aminoacizilor individuali în subunitățile de hemoglobină ale oamenilor, apare adesea glicarea ambelor subunități pe aminoacizi speciali. Acesta este rezultatul unei concentrații ridicate de glucoză în sânge și, prin urmare, poate fi utilizat în diagnosticul de laborator pentru a determina nivelul mediu de zahăr din sânge în ultimele câteva luni.
În timpul glicației hemoglobinei, glucoza se atașează covalent la lizina -8, -17, -41, -62 a subunității α, precum și la valină -2, lizină-9, -18, -67, -121 sau - 145 din subunitatea β legată. Dacă o β-hemoglobină glicată este modificată la valină-2 și reziduul de glucoză a fost transformat într-o cetoamină stabilă printr-o aldimină și o reamenajare Amadori , se numește HbA1c .
Transportul oxigenului
Eficienţă
Hemoglobina este o proteină globulară cu o solubilitate foarte bună în apă (solubilitate de până la 5 mmol / l hemoglobină (34%)). 1 g de Hb poate lega 1,389 ml de oxigen in vitro , dar numai 1,34 ml in vivo ( numărul lui Hüfner ), deci 100 ml de sânge conținând aproximativ 15 g de Hb pot conține până la 15 × 1,34 ml la 100% saturație = Absorbe 20,1 ml de oxigen.
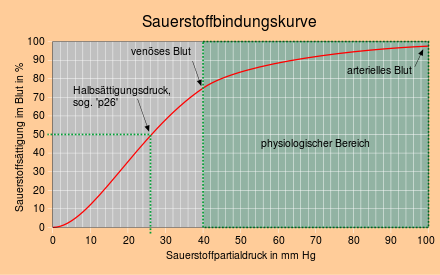
Se observă cursul sigmoidal (în formă de S) al curbei de legare. În mod normal, ne-am aștepta ca sarcina de oxigen să crească inițial brusc și apoi mai încet odată cu creșterea presiunii parțiale de oxigen , ca în cazul mioglobinei (curs hiperbolic). Pentru hemoglobină, curba de legare a oxigenului este neobișnuit de plană în zona presiunii parțiale de oxigen care predomină în plămâni și neobișnuit de abruptă în zona presiunii parțiale de oxigen care predomină în țesut. Cursul plat al curbei de legare în secțiunea finală previne o scădere mai mare a saturației cu oxigen la vârstă înaintată, cu disfuncție pulmonară și la altitudini mari, iar cursul mai abrupt în secțiunea mijlocie asigură eliberarea multor oxigen atunci când oxigenul venos scăderi parțiale de presiune.
Interval normal
Pentru așa-numita „hemoglobină adultă” (a se vedea mai jos), care este predominantă la adulți, a fost stabilit un interval normal. Alte valori standard se aplică copiilor.
Intervalul normal este intervalul în care se află valorile Hb de 96 la sută din totalul persoanelor sănătoase.
| g / dl (unitate veche) |
mmol / l ( unitate SI ) |
|
|---|---|---|
| bărbați | 13.5-17.5 | 8.4-10.9 |
| femei | 12-16 | 7.4-9.9 |
| Nou nascut | 19 | 11.8 |
O valoare crescută a hemoglobinei înseamnă, de obicei, un număr crescut de eritrocite ( poliglobulia ) și poate de ex. B. apar atunci când rămâneți la altitudini mari (lipsa oxigenului) sau din cauza pierderii de lichide. Dacă cauza nu este clară, trebuie clarificat, de asemenea, dacă valorile semnificativ crescute se datorează bolii policitemia vera .
O scădere a valorii hemoglobinei se numește anemie , o sarcină scăzută a celulelor roșii din sânge cu hemoglobină se numește hipocromazie .
O valoare crescută / scăzută a hemoglobinei depinde întotdeauna de valoarea normală. Dacă valoarea normală este de 10,9 mmol / l, o valoare de 8,4 mmol / l poate duce la simptome de anemie . Dacă valoarea normală este de 9 mmol / l, nu apar simptome la 8,4 mmol / l.
Nivelul valorii hemoglobinei este decisiv pentru aprobarea donării de sânge . Bărbații trebuie să aibă o valoare minimă de 8,4 mmol / l (13,5 g / dl), femeile una de 7,8 mmol / l (12,5 g / dl) pentru a fi aprobați de către medicul donator. Valoarea Hb este determinată utilizând un fotometru de măsurare electronic Hb . Informațiile actuale de la serviciul de donare a sângelui DRK spun că bărbaților cu o Hb> 11,2 mmol / l (18,0 g / dl) nu li se mai permite să doneze (12/2006). Cu toate acestea, acest lucru nu este cazul în toate statele federale; dacă valoarea Hb este crescută, se recomandă consumul suplimentar de lichide înainte de donație.
Determinarea conținutului de hemoglobină se bazează pe detectarea grupelor hem de proteine. Prin urmare, concentrația de hemoglobină molară este dată în mod tradițional ca concentrația subunităților individuale ( masa molară medie : 16114,5 g / mol). Factorul de conversie de la g / dl la mmol / l este, prin urmare, de 0,6206. Conform IUPAC și DIN 58931, concentrația (monomerică) de hemoglobină calculată în acest mod este denumită Hb (Fe) . Deoarece o moleculă de complex de hemoglobină este formată din 4 subunități, fiecare cu un grup hem, valorile date în mmol / l trebuie împărțite la 4 pentru a obține concentrația tetramerului de hemoglobină (denumită Hb conform IUPAC și DIN 58931 ) (masa molară: 64458 g / mol). Factorul de conversie de la g / dl la mmol / l este, prin urmare, de 0,1551. Valorile date în g / dl rămân neschimbate.
Legarea oxigenului prin hemoglobine la nivel molecular
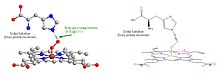
Când oxigenul este legat, o moleculă de dioxigen (O 2 ) este absorbită în centrul complexului hem. Atomul ionului central de fier (Fe II ) se transformă într-o stare de spin redus datorită legăturii de oxigen . În acest proces, dimensiunea sa este redusă și alunecă în planul inelului de porfirină.
Molecula de oxigen legată este stabilizată printr-o punte de hidrogen . Aceasta se formează cu lanțul lateral al proteinei globinei : un reziduu distal de histidină care se află lângă atomul central. Reziduul proximal de histidină, prin care atomul de fier al hemului este legat de matricea proteică, se află pe cealaltă parte a planului inelului.
Efect cooperativ asupra legării oxigenului
O hemoglobină, care constă din patru subunități Hb, poate lega patru molecule de oxigen. Din considerente pur statistice, ar fi de așteptat ca efortul de a lega alte molecule de oxigen să scadă cu fiecare moleculă de oxigen care este deja legată. Cu toate acestea, studiile au arătat că este opusul și că afinitatea cu oxigenul crește odată cu creșterea sarcinii ( cooperativitate pozitivă ).
Dependența valorii pH-ului de legarea oxigenului
Echilibrul dintre forma R și T este dependent de pH ( efect Bohr ) și este deplasat la o valoare scăzută a pH-ului prin protonație în favoarea formei T mai puțin oxigenate. Același efect are un nivel ridicat de CO 2 - presiunea parțială de reversibilă carboxilare a subunităților. Acest lucru duce la concentrații mari de protoni și dioxid de carbon , precum cele găsite în ex. B. prevalează prin respirația celulară și fermentarea acidului lactic în mușchiul care lucrează, favorizează o descărcare completă a hemoglobinei.
Concurență între oxigen și monoxid de carbon
Monoxidul de carbon (CO) este foarte toxic deoarece concurează cu oxigenul pentru punctele de coordonare axială ale centrelor de fier. Odată legat, CO poate de ex. B. poate fi deplasat doar prin tratarea presiunii oxigenului într-o cameră de presiune - deci blochează locurile de legare pentru oxigen. La fumătorii înalți, până la 10% din hemoglobină este ocupată de CO. Monoxidul de carbon se leaga de 25000 ori mai puternic la
hem liber b decât dioxigenați, dar numai aproximativ 200 de ori in hemoglobina. Motivul afinității reduse a CO este că, datorită spațiului necesar histidinei distale, nu este posibilă coordonarea liniară Fe-CO preferată de monoxidul de carbon.
Efecte care afectează legarea oxigenului
Curba de legare a oxigenului este deplasată spre dreapta pe abscisă prin:
- Creșterea temperaturii
- Scăderea pH-ului
- Creșterea concentrației de 2,3-bifosfoglicerat în eritrocite
- Creșterea concentrației de dioxid de carbon
Trecerea la dreapta face ca hemoglobina de eliberare mai ușor de oxigen . Un exemplu: un mușchi care lucrează are nevoie de mult oxigen pentru a se contracta . Deoarece transformă o parte din energie în căldură, temperatura crește în mușchii care lucrează. De asemenea, eliberează acid lactic și valoarea pH-ului scade. Metabolismul crescut produce mai mult dioxid de carbon: efectele locale permit mușchilor să preia mai mult oxigen din sânge.
- Mușchii au mioglobină (vezi mai jos), care are o afinitate mai mare pentru oxigen (atrage mai mult oxigen). Acesta servește ca un depozit de oxigen.
Curba de legare a oxigenului este deplasată spre stânga pe abscisă prin:
- Scăderea temperaturii
- Creșterea pH-ului
- Scăderea concentrației de 2,3-bifosfoglicerat în eritrocite
- Scăderea concentrației de dioxid de carbon
Schimbarea stânga determină hemoglobinei de a lega oxigenul mai strâns. Acest lucru se face z. B. în operațiile cardiace prin hipotermie pentru a-i satura sângele la maximum cu oxigen. Animalele care hibernează beneficiază și ele de acest efect. În plămâni, o parte din dioxidul de carbon este eliberat în cursul expirației - Hb poate fi reîncărcat cu oxigen mai ușor.
2,3-bisphosphoglycerate format de enzima bisphosphoglycerate mutază în ciclul Rapoport-Luebering (traseul de ocolire glicoliza) este cel mai important intermediar în glicolizei în celulele roșii din sânge. Se leagă de hemoglobină și provoacă un efect alosteric ; scăderea afinității hemoglobinei pentru oxigen. Este vital să se permită eliberarea de oxigen în organism. În condiții fiziologice, 2,3-BPG este prezent în celulele roșii din sânge în aproximativ aceeași concentrație ca hemoglobina. O creștere a concentrației de 2,3-BPG este de ex. B. de observat în timpul reglării înălțimii. Scopul acestei reglementări este următorul: Dacă saturația de oxigen din sânge este redusă de „aerul subțire” la altitudine mare, Hb eliberează oxigenul legat consumatorului mai slab decât cu saturația mare (vezi curba de legare). Cu toate acestea, alimentarea tuturor organelor cu O 2 trebuie garantată. Deci, Hb trebuie să devină mai puțin afin pentru oxigen pentru a furniza în mod adecvat periferia .
Tipuri de hemoglobină
Diferite hemoglobine pot fi găsite la om în diferite faze ale vieții (faza embrionară, faza fetală și după naștere, adică „faza adultă”). Aceste hemoglobine diferă prin afinitatea lor pentru oxigen. Fiecare dintre ele constă din patru subunități în perechi de compoziții diferite.
Din punct de vedere istoric, diferitele subunități ale hemoglobinei au fost create prin duplicarea genei globinei. Combinațiile acestor subunități ca tetrameri sunt sintetizate în momente diferite în funcție de cererea de oxigen , de exemplu pentru a obține oxigen din sângele matern ca făt în uter.
În timpul sarcinii , oxigenul este transportat prin placentă ( placentă ) la făt , pe care apoi îl preia eficient. Acest lucru este asigurat de faptul că tipurile de hemoglobină embrionară și fetală au o afinitate semnificativ mai mare de legare a oxigenului decât hemoglobina adultă formată mai târziu după naștere. În plus, hematocritul este mult crescut în comparație cu mama. Acest lucru permite suficient oxigen să ajungă la făt prin cordonul ombilical.
Hemoglobine embrionare
Cele hemoglobins embrionare sunt formate in faza embrionara, primele 8 săptămâni după fertilizare, în insule de sânge ale sacului vitelin și au nume proprii:
- Gower-1 (ζ 2 ε 2 ) ("zeta-epsilon")
- Gower-2 (α 2 ε 2 ) ("alfa-epsilon")
- Portland-1 (ζ 2 γ 2 ) ("zeta-gamma")
- Portland-2 (ζ 2 β 2 ) („zeta-beta”)
Hemoglobine fetale
Ca hemoglobină fetală , se numește hemoglobina F (HbF) formată în principal în perioada fetală (de la a 9-a săptămână după concepție până la naștere). Sinteza hemoglobinei fetale începe în faza embrionară anterioară și nu este oprită imediat după naștere, ci continuă câteva luni. Locul de formare sunt ficatul și splina . Are o afinitate mult mai mare pentru oxigen decât hemoglobina adultă pentru a lua oxigenul din sângele matern.
- Hemoglobina F (α 2 γ 2 ) - Hemoglobina dominantă la făt, detectabilă doar în urme la adulții sănătoși
Hemoglobine adulte
Cele hemoglobins adulte sunt hemoglobina A (α 2 β 2 ; HbA 0 [anterior numit Hb A 1 , denumirea HbA 1c reprezintă o formă glicozilată]) și hemoglobina A 2 (α 2 δ 2 ; HbA 2 ). Sinteza hemoglobinelor adulte începe la făt și apoi înlocuiește hemoglobina fetală în primele câteva luni după naștere. Locul educației este măduva osoasă . În primul an de viață, expresia genei γ este redusă și cea a genei β este crescută. Factorul de transcriere BCL11A este represorul decisiv al γ-globinei la adulți. Prin urmare, hemoglobina fetală este detectabilă doar la urme la adulți.
- Hemoglobina A (α 2 β 2 ) - 98%
- Hemoglobina A 2 (α 2 δ 2 ) - 2%.
Glicohemoglobine
Glicohemoglobinele se formează prin legarea glucozei de grupările amino ale globinelor. În condiții fiziologice, acest lucru se întâmplă non-enzimatic prin contactul hemoglobinei cu zahărul din sânge ( glicație ). Componenta principală HbA 0 a hemoglobinei A este transformată în principal în HbA 1c , în care glucoza este legată de aminoacidul N- terminal valină al lanțului β. Proporția respectivă de HbA 1c în hemoglobina totală este interpretată ca o indicație a nivelului mediu de zahăr din sânge în ultimele câteva săptămâni.
Methemoglobina
Methemoglobina (Met-Hb) este o formă dezactivată, non-oxigen-afină de hemoglobină în care ionul de fier se află la nivelul de oxidare III în loc de II. NADH -dependente enzimă methemoglobină reductaza (diaphorase I) este capabil de a converti methemoglobina înapoi în hemoglobină. De obicei, două procente din hemoglobina umană este methemoglobina. O proporție mai mare poate fi fie genetică, fie rezultatul otrăvirii. O proporție mare de metemoglobină are ca rezultat un aport inadecvat de oxigen către organism.
Defalcarea hemoglobinei
Când celulele roșii din sânge au ajuns la sfârșitul vieții (aproximativ 120 de zile), acestea sunt descompuse în fagocitele mononucleare în principal în splină (și în ficat și măduva osoasă dacă există un nivel ridicat de hemoglobină degradabilă). Procesul de descompunere începe în splină și continuă în ficat. În primul rând, porțiunea de globină este separată de hem și degradată în aminoacizi. Hemul este împărțit în biliverdină printr-o oxigenază dependentă de citocromul P450 ( hemooxigenază ), eliberând fier (Fe 2+ ) și monoxid de carbon. Fierul este eliberat de macrofage către transferina proteinelor de transport , care este prezentă în sânge . Reductaza biliverdin transformă în final biliverdin verzui în bilirubină . Acesta este eliberat în sânge și cuplat cu albumina (deoarece este slab solubil în apă) și transportat la ficat. Aici bilirubina este conjugată de două ori cu acid glucuronic și astfel se face solubilă - acum poate fi eliberată în intestin cu bila și excretată în scaun. În intestin, bacteriile se asigură că acidul glucuronic este parțial descompus din nou și, astfel, bilirubina portocalie este redusă la urobilinogen incolor și sterkobilinogen maro . O mică parte din această bilirubină redusă este preluată din nou prin intestin (circulație enterohepatică) și excretată prin rinichi (culoarea galbenă a urinei ). Diferite boli ale ficatului, cum ar fi inflamația ficatului ( hepatită ) sau obstrucția drenajului în vezica biliară (calculi biliari) duc la o concentrație crescută de bilirubină. Bilirubina este pigmentul care, atunci când este depus în piele, duce la așa-numita icter (icter = îngălbenirea pielii și dermul ( sclera ) ochilor).
Rolul în boală
Mutațiile din HBA1 - gena pot fi defecte ale subunității α și aceasta asupra corpurilor Heinz - anemie și α-talasemie conduc. Mutațiile genei HBB pot provoca anemie corporală Heinz, β-talasemie și anemie cu celule secera . Unele variante ale HBG1 / HBG2 gene poate provoca icter neonatal .
Scăderea nivelului de hemoglobină, cu sau fără o reducere a numărului de globule roșii, duce la simptome de anemie . Există multe cauze ale anemiei, deficitul de fier fiind cea mai frecventă cauză în lumea occidentală. Sinteza hemului este inhibată de deficit de fier. Ca urmare, globulele roșii din sânge sunt hipocromice (lipsite de culoarea roșie) și microcice (mai mici decât în mod normal).
Într-o hemoliză (degradarea crescută a celulelor roșii din sânge) intră icterul , cauzat de metabolitul hemoglobinei bilirubină . Până la o cantitate de 135 mg / dl, hemoglobina eliberată în vasele de sânge este legată de haptoglobină ; dacă sângele cade puternic, apare hemoglobina liberă în sânge ( hemoglobinemie ).
Un grup de defecte genetice cunoscute sub numele de porfirii perturbă sinteza hemului. Acumularea precursorilor hemului are ca rezultat fotosensibilitate, dureri abdominale și probleme neurologice, precum și porfirinurie, printre altele .
În methemoglobinemie, hemoglobina prezentă în celulele roșii din sânge, care este utilizată pentru transportul oxigenului, este transformată în methemoglobină nefuncțională și, prin urmare, nu mai este disponibilă pentru transportul oxigenului. Cauza acestui lucru poate fi ereditară ( metemoglobinemie congenitală ) sau poate fi declanșată de toxine.
Mutațiile din lanțurile de globină sunt asociate cu diferite hemoglobinopatii , cum ar fi anemia falciformă și talasemia .
Agenții patogeni ai malariei descompun hemoglobina din celulele roșii din sânge pe care le-au infectat pentru a produce proteine pentru propriul lor metabolism. Hemul creează hemozoină , care este cristalizată de parazit și poate fi văzută ca un pigment în eritrocitele infectate la microscop . Medicamentul împotriva malariei, clorochina inhibă această cristalizare, iar parazitul este otrăvit de hem.
dovada
Hemoglobina este detectată folosind testul Teichmann, în care sângele este încălzit cu grijă cu sare de masă și acid acetic glacial , prin care se depun hemin (cristale Teichmann) sau cu reacția luminolului , în care o soluție de luminol și soluție de hidroxid de sodiu și se utilizează o soluție de peroxid de hidrogen . Această reacție are loc numai în prezența unui catalizator; dacă se detectează hemoglobină, acesta ar fi ionul de fier (II) din complexul hem.
Hemoglobina în artă și muzică

- În 2005, artistul germano-american Julian Voss-Andreae a creat o sculptură bazată pe structura hemoglobinei. Ruginirea intenționată a lucrării este o aluzie la oxigenarea hemului.
- Trupa britanică de rock Placebo a înregistrat o melodie numită Hemoglobină .
- Rapperul francez MC Solaar a lansat un single de succes în 1994, numit La concubine de l'hémoglobine .
- Trupa melodică germană de death metal Deadlock are o melodie numită „Killing The Time With Hemoglobin” cu o durată de 11 minute pe albumul lor „The Arrival”.
Dovezi individuale
- ^ Friedrich Ludwig Hünefeld: Chemism in the animal organization. Brockhaus, 1840 ( previzualizare limitată în căutarea de carte Google).
- ↑ O rețetă NASA pentru cristalografia proteinelor. (PDF; 782 kB) În: Brief educativ. National Aeronautics and Space Administration, accesat la 2 februarie 2016 .
- ↑ F. Hoppe-Seyler: Despre oxidarea sângelui viu . În: Med-chem Exam Lab . bandă 1 , 1866, p. 133-140 .
- ↑ Georg Hoppe-Seyler: Felix Hoppe-Seyler - medic și om de știință naturală .
- ^ William Küster: Contribuții la cunoașterea bilirubinei și a häminului. În: Jurnalul Hoppe-Seyler pentru chimie fiziologică . Nr. 82, 1912, p. 463 și urm.
- ↑ MF Perutz, MG Rossmann, AF Cullis, H. Muirhead, G. Will, ACT de Nord: Structura H . În: Natura . bandă 185 , nr. 4711 , 1960, pp. 416-422 , doi : 10.1038 / 185416a0 , PMID 18990801 .
- ^ MF Perutz: Structura hemoglobinei . În: Simpozioane Brookhaven în biologie . bandă 13 noiembrie 1960, ISSN 0068-2799 , pp. 165-183 , PMID 13734651 .
- ↑ MF Perutz, H. Muirhead, JM Cox și colab .: sinteza tridimensională Fourier de cal oxihemoglobina la rezolutie 2.8 A: (1) Analiza de raze X . În: Natura . bandă 219 , nr. 5149 , iulie 1968, p. 29-32 , doi : 10.1038 / 219029a0 , PMID 5659617 .
- ^ MF Perutz, H. Muirhead, JM Cox, LC Goaman: Sinteza tridimensională Fourier a oxihemoglobinei calului la o rezoluție de 2,8 A: modelul atomic . În: Natura . bandă 219 , nr. 5150 , iulie 1968, p. 131-139 , PMID 5659637 .
- ↑ HbA1c și hemoglobina glicată ( Memento 29 ianuarie 2012 în Arhiva Internet ) Canterbury Scientific.
- ↑ UniProt P69905 , UniProt P68871
- ↑ JM Berg, JL Tymoczko, L. Stryer: Biochimie. Ediția a 6-a. Spektrum Akademischer Verlag, München 2007, ISBN 978-3-8274-1800-5 , pp. 208ff.
- ^ Robert F. Schmidt, Gerhard Thews (ed.): Fiziologia oamenilor . Ediția a 25-a. Springer-Verlag, Berlin 1993, ISBN 3-541-02636-7 , pp. 616-620 .
- ↑ Erich Schütz, Heinz Caspers, Erwin-Josef Speckmann (eds.): Fiziologie . Ediția a 16-a. Urban & Schwarzberg, München 1982, ISBN 3-540-57104-3 , pp. 86-87 .
- ↑ a b c d R. Zander, W. Lang, P. Lodemann: Greutatea moleculară a hemoglobinei . Adus la 13 august 2013.
- ↑ GS Adair: Sistemul de hemoglobină VI. Curba de disociere a oxigenului a hemoglobinei. În: J Biol Chem . Volumul 63, 1925, pp. 529-545.
- ↑ DE Koshland, G. Némethy, D. Filmer: Compararea datelor experimentale de legare și a modelelor teoretice în proteinele care conțin subunități. În: Biochimie . Volumul 5, numărul 1, ianuarie 1966, pp. 365-385, ISSN 0006-2960 . PMID 5938952 .
- ^ Pschyrembel Online. Adus pe 29 iulie 2021 .
- ↑ Hemoglobinopatii în poziție fetală | NEJM. Accesat la 31 ianuarie 2019 .
- ^ Vijay G. Sankaran, Tobias F. Menne, Jian Xu, Thomas E. Akie, Guillaume Lettre: Expresia hemoglobinei fetale umane este reglementată de represorul specific etapei de dezvoltare BCL11A . În: Science (New York, NY) . bandă 322 , nr. 5909 , 19 decembrie 2008, ISSN 1095-9203 , p. 1839-1842 , doi : 10.1126 / science.1165409 , PMID 19056937 .
- ↑ UniProt P69905 , UniProt P68871 , UniProt P69891
- ↑ Wolfgang Piper: Medicină internă . Ediția a II-a. Springer, Berlin 2002, ISBN 978-3-642-33108-4 , pp. 639-640 .
- ↑ Constance Holden: Sânge și oțel . În: Știință . bandă 309 , nr. 5744 , 30 septembrie 2005, p. 2160 , doi : 10.1126 / science.309.5744.2160d ( sciencemag.org [PDF]).
- ↑ L. Moran, RA Horton, G. Scrimgeour, M. Perry: Principiile biochimiei . Pearson, Boston, MA 2011, ISBN 978-0-321-70733-8 , pp. 127 .
literatură
- MF Perutz: Stereochimia efectelor de cooperare în hemoglobină. În: Natura. Volumul 228, numărul 5273, noiembrie 1970, pp. 726-739, ISSN 0028-0836 . PMID 5528785 .
- L. Makowski, J. Bardhan și colab.: Studii WAXS asupra diversității structurale a hemoglobinei în soluție. În: Journal of Molecular Biology , Volumul 408, Numărul 5, mai 2011, pp. 909-921, ISSN 1089-8638 . doi: 10.1016 / j.jmb.2011.02.062 . PMID 21420976 . PMC 3081904 (text complet gratuit).
- T. Yonetani, M. Laberge: Dinamica proteinelor explică comportamentele alosterice ale hemoglobinei. În: Biochimica et biophysica acta , Volumul 1784, Numărul 9, septembrie 2008, pp. 1146-1158. doi: 10.1016 / j.bbapap.2008.04.025 . PMID 18519045 . PMC 2668241 (text complet gratuit). (Revizuire).
- Martin D. Vesper, Bert L. de Groot, Dennis R. Livesay: Colective Dynamics Underlying Allosteric Transitions in Hemoglobin. În: PLoS Computational Biology. Volumul 9, 2013, articolul e1003232, doi: 10.1371 / journal.pcbi.1003232 .
Link-uri web
- Model 3D interactiv al hemoglobinei - Proteopedia
- Molecula lunii: hemoglobină (engleză)
- Jennifer McDowall / Interpro: Proteina lunii: hemoglobina. (engl.)