Hidroxid de calciu
| Structură cristalină | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| __ Ca 2+ __ OH - | |||||||||||||||||||
| General | |||||||||||||||||||
| Nume de familie | Hidroxid de calciu | ||||||||||||||||||
| alte nume |
|
||||||||||||||||||
| Formula raportului | Ca (OH) 2 | ||||||||||||||||||
| Descriere scurta |
solid incolor, inodor |
||||||||||||||||||
| Identificatori externi / baze de date | |||||||||||||||||||
| |||||||||||||||||||
| proprietăți | |||||||||||||||||||
| Masă molară | 74,10 g · mol -1 | ||||||||||||||||||
| Starea fizică |
cu fermitate |
||||||||||||||||||
| densitate |
2,24 g cm −3 (20 ° C) |
||||||||||||||||||
| Punct de topire |
Se descompune la 550 ° C |
||||||||||||||||||
| solubilitate |
sărac în apă (1,7 g l -1 la 20 ° C) |
||||||||||||||||||
| instructiuni de siguranta | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
Elveția: 5 mg m −3 (măsurat ca praf inhalabil ) |
||||||||||||||||||
| Date toxicologice | |||||||||||||||||||
| În măsura în care este posibil și obișnuit, se utilizează unități SI . Dacă nu se specifică altfel, datele furnizate se aplică condițiilor standard . | |||||||||||||||||||
Hidroxidul de calciu (de asemenea: var hidratat , var stins , var alb (var) hidratat , var hidratat ) este hidroxidul de calciu .
Apariție
Hidroxidul de calciu apare de asemenea în mod natural ca portlandit mineral .
Extragerea și prezentarea
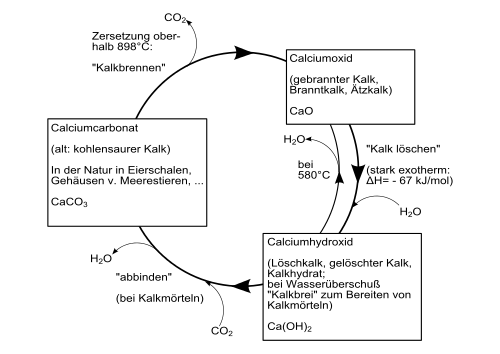
Hidroxidul de calciu se formează cu o puternică dezvoltare a căldurii ( reacție exotermă ) atunci când oxidul de calciu este amestecat cu apă. Acest proces este numit și sacrificarea varului . Dezvoltarea căldurii este atât de puternică încât o parte din apă se evaporă și ea (cunoscută în mod colocvial sub numele de „fumat”).
Următoarea diagramă oferă o prezentare generală a proceselor de conversie între diferiți compuși ai calciului ( ciclul tehnic al varului ) :
De asemenea, este posibil să se afișeze prin reacția soluțiilor apoase de sare de calciu cu soluții alcaline (de exemplu azotat de calciu cu hidroxid de potasiu ).
Hidrura de calciu sau calciu în sine reacționează violent cu apa pentru a forma hidroxid de calciu și hidrogen .
proprietăți
Hidroxidul de calciu este o pulbere incoloră care se dizolvă doar ușor în apă. Solubilitatea depinde de temperatură și scade odată cu creșterea temperaturii: 1860 mg / l la 0 ° C; 1650 mg / l la 20 ° C și 770 mg / l la 100 ° C. La 580 ° C se descompune, producând oxid de calciu și apă. Hidroxidul de calciu este format din cristale trigonale cu politipul 2H al structurii cristaline de tip iodură de cadmiu ( grup spațial P 3 m 1 (grup spațial nr. 164) , a = 3.584, c = 4.896 Å ).
Deși hidroxidul de calciu nu este foarte solubil, acesta are o reacție puternic bazică : valoarea pH-ului unei soluții saturate este de 11-12,6.
utilizare
Scopul principal al hidroxidului de calciu este prepararea mortarului în construcții. Se folosește acolo sub denumirea de hidrat de var alb (DIN 1060). Tencuielile de var sunt formate din amestecuri de hidroxid de calciu și nisip. Acesta din urmă poate fi adăugat și sub formă de calcar măcinat . Hidroxidul de calciu se adaugă tot mai mult la amestecul de asfalt pentru a îmbunătăți durabilitatea stratului de asfalt finit.
Hidroxidul de calciu se formează atunci când cimentul Portland se întărește. Cimentul Portland este utilizat în principal pentru fabricarea betonului armat . Efectul alcalin al hidroxidului de calciu din beton împiedică ruginirea oțelului de armare până când este neutralizat de acid carbonic (sau de alte componente acide ale apei de ploaie, de exemplu).
Efectul antiseptic , caustic, care împiedică creșterea agenților patogeni și a mucegaiului , este motivul pentru care varul stins a fost folosit anterior pentru dezinfectarea grajdurilor („varul” grajdurilor).
Împreună cu sifonul și săpunul lubrifiant , calcarul învelit în coajă este prelucrat în Tadelakt , un tencuială hidrofobă de var pentru camere umede .
Varul este utilizat pentru a îmbunătăți capacitatea portantă a șantierului. Un sol cu un conținut de apă prea mare și capacitatea portantă scăzută rezultată și compactabilitatea slabă pot fi îmbunătățite prin amestecarea cu 2-4% var MA. Varul leagă o parte din apă și astfel îmbunătățește, printre altele, plasticitatea, compresibilitatea și capacitatea portantă. De aceea, îmbunătățirea solului cu var este o metodă de îmbunătățire imediat realizabilă a ușurinței de instalare și a facilitării lucrărilor de construcție.
Varul stins este utilizat ca alternativă la calcarul în desulfurarea gazelor arse , deoarece formează sulfat de calciu (gips) cu acid sulfuric . Cantitatea utilizată este de aproximativ 1,8 ori mai mică decât pentru calcar. Tencuiala rezultată are o albă de 80% și poate fi utilizată comercial. Datorită reactivității sale ridicate, sunt necesare cantități mai mici de consum. Dezavantajul este prețul mai mare comparativ cu calcarul.
În industria alimentară, acesta este adăugat la alimente ca un regulator al acidității și este în general aprobat în UE ca aditiv alimentar cu denumirea E 526 fără restricții de cantitate maximă ( quantum satis ) pentru alimente.
Este, de asemenea, utilizat ca medicament în stomatologie , în principal pentru dezinfectarea canalelor radiculare și a cavităților și pentru stimularea formării de noi dentine .
Face parte din varul de sodă , care este utilizat în mașinile de anestezie sau în mașinile de scufundare cu respirație pentru a elimina dioxidul de carbon din aerul expirat.
Hidroxidul de calciu este, de asemenea, utilizat ca pesticid în pomicultura . Aici este folosit, de exemplu, ca fungicid (un agent împotriva infestării fungice, cum ar fi cancerul copacilor ).
Lime apa este (aproape) saturată soluția de hidroxidcalciu și servește ca un lichid limpedepentru detectarea dioxiduluicarbon prin formarea de carbonat de calciu , care precipită și face tulbure soluție.
Suspensiile în apă sunt:
- Văr gras ( var ): un material cremos, rigid, pentru construcție: mortar de var
- Lime lapte : un albicioasă, lichid lăptos care separă în var carter și var apă - culoare var , neutralizarea acizilor, decarbonizare , desulfurare a gazelor de ardere
Hidroxidul de calciu este utilizat ca produs intermediar în producția de var clorurat și sodă caustică din sodă .
instructiuni de siguranta
Varul ars (nefolosit) ( oxid de calciu , var) și varul stins sunt iritante, contactul cu ochii poate duce la leziuni oculare grave. O soluție apoasă de hidroxid de calciu este alcalină și ușor corozivă. Varul nedezvoltat poate provoca incendii atunci când este expus la apă din cauza dezvoltării căldurii.
Istoric
Reacția exotermă a varului stins a fost considerat unul dintre cele mai mari puzzle - uri de zi cu zi din antichitate în epoca modernă timpurie și a găsit o largă varietate de explicații: În timp ce tatăl bisericii Augustin din Hippo (354-430) , în „său starea lui Dumnezeu “ (21 , 4) fenomenul considerând un fel de dovadă a lui Dumnezeu , filosofii naturali s-au străduit să interpreteze fenomenul în funcție de ideile lor respective. Exemple proeminente sunt:
Seneca cel Tânăr și Stoa
Conform cosmologiei stoice , filosoful roman Seneca cel Tânăr († 65 d.Hr.) a interpretat sacrificarea varului conform teoriei celor patru elemente a lui Aristotel . De oxid de calciu este un fel de „piatră de foc“ pentru el , după ardere, care cedează căldura să - l penetreze apa.
Vitruvius și materiale de construcție antice
În cea de-a doua carte din „Zece cărți despre arhitectură” scrisă în jurul anului 30 î.Hr., vechiul maestru-constructor Vitruv a formulat o știință a materialului de construcție care corespundea înțelegerii timpului său . Acolo, în secțiunile a 2-a și a 5-a, încearcă să găsească o explicație concludentă a slăbirii varului. Pentru a face acest lucru, el combină atomismul grecesc al lui Democrit și Epicur cu modelele geometrice ale materiei lui Pitagora pentru a crea o teorie complet separată a materiei: pentru Vitruvius lumea constă atât din „ atomi ”, cât și din vid (conform lui Democrit / Epicur) și patru elemente, care însă (conform lui Pitagora) sunt solide geometrice. Prin urmare, pentru el „atomii” sunt identici cu corpurile pitagoreice și se mișcă în spațiul gol. La arderea varului, „atomii de apă și de aer” părăsesc calcarul, care este gândit ca o structură de zăbrele făcută din corpuri pitagorice , astfel încât să se creeze „găuri”. Vitruvius explică pierderea în greutate la arsură. Pe de altă parte, „atomii de foc” sunt depozitați. La stingere, „atomii de apă” pătrund prin „găurile” din bulgărul de var și „focul” stocat scapă. Deoarece materialul în sine rămâne neschimbat, aderența nisipului în mortar are loc numai prin porii creați în acest fel. În timp ce această explicație a fost suficientă pentru practica de construcție pură, incompatibilitatea sistemelor combinate de Vitruvius - atomistica nu cunoaște nicio „corpuri atomice” similare din punct de vedere geometric, construind blocuri - în special teoreticienii arhitecturali ai Renașterii care s-au referit la el, precum Cesare Cesariano și Daniele Barbaro , au pus puzzle-uri suplimentare.
Scaliger și Cardano
În secolul al XVI-lea, doi dintre cei mai mari polimați ai timpului lor, Iulius Caesar Scaliger și Gerolamo Cardano , au purtat o dispută de mai mulți ani și au publicat cărți despre natura exactă a lumii. În timp ce Gerolamo Cardano privea materia ca un continuu infinit, care variază doar în „densitatea” ei din loc în loc, Scaliger a considerat că „ vidul ” este factorul determinant pentru cosmos și cauza tuturor mișcărilor. În lucrarea sa principală, De subtilitate ad Cardanum (1557), care este îndreptată împotriva adversarului , Scaliger introduce această înțelegere a materiei ( Exercitatio, 5,8-9 ) folosind nimic altceva decât „enigma varului stins”: Din moment ce o bucată de var absoarbe apa atunci când este curățată, porii săi pot conține doar un „vid”, deoarece „aerul” nu poate scăpa în sus în fața lui, deoarece s-ar întâlni imediat cu alt „aer” și astfel ar fi blocat.
Dovezi individuale
- ↑ Intrare pe HIDROXID DE CALCIU în baza de date CosIng a Comisiei UE, accesată pe 24 februarie 2020.
- ↑ Intrare pe E 526: Hidroxid de calciu în baza de date europeană pentru aditivi alimentari, accesată la 27 iunie 2020.
- ↑ a b c d e fișă tehnică hidroxid de calciu (PDF) de la Merck , accesat la 4 aprilie 2012.
- ↑ a b c d e Intrarea pe hidroxid de calciu , în baza de date a substanței GESTIS IFA , accesat pe 10 ianuarie 2017. (JavaScript este necesar)
- ↑ Fondul elvețian de asigurare a accidentelor (Suva): valori limită - valorile actuale MAK și BAT (căutare 1305-62-0 sau hidroxid de calciu ), accesat la 2 noiembrie 2015.
- ↑ a b c Georg Brauer (Ed.), Cu colaborarea Marianne Baudler și alții: Manual de chimie anorganică preparativă. Ediția a treia, revizuită. Volumul II: Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3 , p. 926.
- ↑ Roland Pfestorf, Heinz Kadner: Chimie: Un manual pentru colegii. ISBN 978-3-81711783-3 , p. 368.
- ↑ Paperback Chemical Substances , ediția a 3-a. Harri Deutsch, Frankfurt a. M., 2007.
- ↑ Dr-Luthardt.de: valoarea pH-ului și produsul de solubilitate al hidroxidului de calciu , accesat pe 21 noiembrie 2019.
- ^ Articol din asfalt 4/2010 pe schaeferkalk.de: Var hidratat în asfalt. , Accesat la 28 februarie 2017.
- ↑ Felix Henke / Laura Thiemann, Vitruvius pe stuc și tencuială - pasajele relevante ale „decem libri de architectura” , în: Firmitas et Splendor. Vitruvius și tehnicile de decorare a pereților , ed. de Erwin Emmerling, Andreas Grüner și colab., München 2014 (studii de la Catedra de restaurare, Universitatea Tehnică din München , Facultatea de Arhitectură) ISBN 978-3-935643-62-7 , pp. 13-125, acolo p. 55 .
- ↑ Thomas Reiser, Lixiviația varului conform teoriilor antice și rinascimentale ale materiei. Note despre Vitruvius 2, 2 și 2, 5. De Cesariano și Barbaro asupra feudului dintre Scaliger și Cardano , în: Firmitas et Splendor (2014), pp. 299-319, acolo pp. 303-304.
- ↑ Henke / Thiemann (2014), pp. 57-59; Reiser (2014), pp. 306-312.
- ↑ Reiser (2014), pp. 314-317.