Porfirine
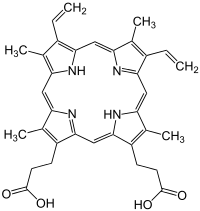
Porfirine (din greaca veche πορφυρά porphyrá , colorant violet ) sunt coloranți organici-chimice care constau din patru pirol inele ( tetrapirolic ) , care sunt în mod ciclic legate de patru grupuri metina . Cel mai simplu reprezentant este porfina . Porfirinele sau compușii înrudiți cu porfirina vin de ex. B. și ca clorofilă și ca hem în proteinele pe bază de hem, hemoglobina și diferiții citocromi . Hemul este un compus complex cu protoporfirină IX și un ion de fier ca atom central în locul celor doi atomi de hidrogen. Un hem fără fier este de ex. B. Hematoporfirina .
Importanța porfirinelor
Porfirinele, a căror structură a fost descrisă în detaliu pentru prima dată de chimistul Hans Fischer , joacă un rol central în metabolismul uman. Pe lângă transportul oxigenului din sânge prin grupul hem legat în pigmentul roșu din sânge, acestea apar în multe enzime, de ex. B. catalaza (detoxifierea peroxidului de hidrogen) și enzimele lanțului respirator din mitocondrie. Vitamina B 12 produsă bacterial conține, de asemenea, o componentă asemănătoare porfirinei, și anume corina . Produsele de descompunere cu lanț deschis ale pigmentului roșu din sânge din organism sunt responsabile pentru colorarea urinei, a scaunului și a bilei. Bolile legate de porfirine sunt de ex. B. hepatita, în care deteriorarea hemului duce la îngălbenirea pielii ( icter ) sau tulburările moștenite de acumulare a hemului ( porfirii ), în care se acumulează substanțe precursoare și duc la intoleranță severă la lumină, dureri abdominale și leziuni ale nervilor.
Unele porfirine pot fi utilizate pentru a determina medicamente în sânge, de ex. B. prin intermediul FPIA ( Fluorescence Polarization Immunoassay ), faceți imposibil sau falsificați.
| proteină | Grup de substanțe | metal central | funcţie |
|---|---|---|---|
| hemoglobină | Häme (grup de substanțe) | Transportul oxigenului | |
| Photosystem | Clorofile | Absorbția luminii | |
| Citocrom c | Häme (grup de substanțe) | Transportul electronilor | |
| Citocromul P450 | Häme (grup de substanțe) | Oxigenaze |
biosinteza
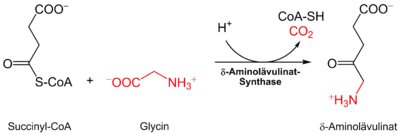
În corpul uman, biosinteza tuturor porfirinelor începe de la succinil-CoA și aminoacidul glicină . Are loc parțial în citosol și parțial în spațiul intermembranar mitocondrial . Prin urmare, substraturile și produsele de reacție trebuie să treacă de mai multe ori membrana mitocondrială; proteinele de transport responsabile pentru aceasta sunt încă complet necunoscute.
Sintaza-δ aminolevulinat catalizează conectarea glicină și succinil-CoA la a-amino-β-ketoadipate, care decarboxilat spontan la δ-aminolevulinat :
Plante , alge , bacterii (cu excepția alphaproteobacteria ) și bacteriile archeal pot produce , de asemenea δ-aminolevulinat de glutamic acid care este denumit calea C5 sau Beale. Aminoacidul legat de un ARNt este redus de glutamil-ARNt reductază la glutamat-1-semialdehidă cu consum de NADPH. Acesta este în cele din urmă transformat în δ-aminolevulinat, care este catalizat de glutamat-1-semialdehidă aminotransferază . Cu toate acestea, nu s-a dovedit încă că bacteriile posedă atât calea C5, cât și calea sintetică descrisă mai sus prin δ-aminolevulinat sintază.
Patru dintre aceste molecule sunt transformate în hidroximetilbilan de către porfobilinogen deaminază, cu eliminarea a patru molecule de amoniac . Alte conversii au loc pas cu pas prin uroporfirinogen III ( uroporfirinogen III sintază ) și coproporfirinogen III ( uroporfirinogen decarboxilază ) în protoporfirinogen IX ( coproporfirinogen oxidază ) și protoporfirinină IX ( protoporfirinogen oxidază ).
Defalcarea și excreția
Hemooxygenase convertește hema roșu la verde biliverdin prin deschiderea porfirinei inelul și Scindarea de fier și monoxid de carbon . Reductaza biliverdin reduce la roșu-portocaliu bilirubina . Bilirubina este secretată în intestin prin bilă și 75 până la 80% din bilirubina secretată este excretată cu fecalele , restul fiind supus circulației enterohepatice .

Alte produse de degradare a bilirubinei, cum ar fi sterkobilinogenul incolor (care este transformat de bacteriile intestinale în dipirrolii maroni mesobilifuchsin și bilifuchsin) și sterkobilinul galben portocaliu contribuie la culoarea normală a scaunului. Produsele de degradare a bilirubinei sunt parțial reabsorbite și, ca urobilinogen și urobilin, contribuie la culoarea galbenă a urinei .
Molecule legate de porfirină
 Derivați de porfirină |
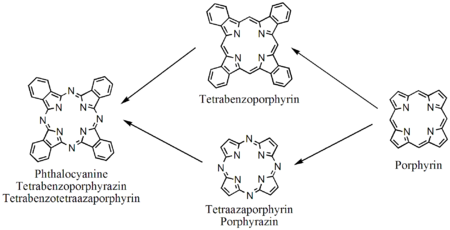 Tetraazoporfirine, ftalocianine |
Dovezi individuale
- ^ Otto Warburg : problema enzimei și oxidările biologice. În: Buletinul spitalului Johns Hopkins. Volumul 46, 1930, pp. 341-358; de asemenea în: Albert Faulconer, Thomas Edward Keys: Otto Heinrich Warburg. În: Fundamentele anesteziei. Charles C Thomas, Springfield (Illinois) 1965, pp. 1288-1302, aici: p. 1301 ( Constituția chimică a enzimei ).
- ↑ EC 2.3.1.37 (δ-aminolevulinat sintază).
- ↑ EC 1.2.1.70 (glutamil-ARNt reductază).
- ^ H. Panek, MR O'Brian (2002): O viziune asupra întregului genom al biosintezei hem procariote . În: Microbiologie. 148, 2273-2282. PMID 12177321 .
- ↑ Beale, SI (1990): Biosinteza precursorului pigmentului tetrapirol, acidul d-aminolevulinic, din glutamat. În: Fiziologia plantelor. 93 (4), 1273-1279. PMID 16667613 ; PMC 1062668 (text complet gratuit, PDF).